题目内容
干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为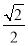 a(其中a为立方体棱长)的CO2有( )。
a(其中a为立方体棱长)的CO2有( )。
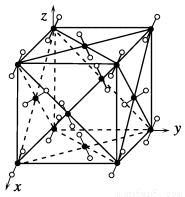
A.4个 B.8个 C.12个 D.6个
C
【解析】每个CO2周围距离为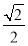 a的CO2为12个。
a的CO2为12个。

Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
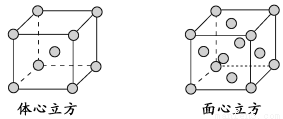
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1 073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是___________________________________________________________________________。
CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
请回答下列有关问题:
估计钙元素的电负性的取值范围:________<X<________。经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中形成的化学键的类型及其理由:__________________________。
