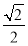题目内容
下列各组物质中,按熔点由低到高排列的是( )。
A.O2、I2、Hg B.CO2、Al2O3、KCl
C.Na、K、Rb D.H2S、H2Se、H2Te
D
【解析】A项可联系三种物质在常温下的状态判断,O2为气体,I2为固体,Hg为液体,熔点应为O2<Hg<I2;B项中CO2为气体,而KCl和Al2O3为离子化合物,在常温下均为固体,由离子半径K+>Al3+,Cl->O2-且后者电荷数高于前者,可知Al2O3的熔点应高于KCl;C项碱金属的熔、沸点随核电荷数增大而降低;D项中三种物质为氧族元素的气态氢化物,它们的相对分子质量依次增大,范德华力依次增大,熔点依次升高。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量(mol) | 0.2 | 0.2 | 0 |
平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A.反应可表示为2X+3Y 2Z,其平衡常数为8 000
2Z,其平衡常数为8 000
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡向正反应方向移动
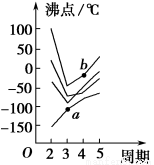
A、B、C、D、E五种元素,A元素的周期数、主族数、原子序数相同;B的基态原子核外有3种能量不同的原子轨道,且每种轨道中的电子数相同;C元素的电离能如图所示;D元素的价电子构型为nsnnpn+2;E是第4周期的过渡元素,血红蛋白中的E元素与BD形成的配位键比与D2形成的配位键强。E单质与BD形成的配合物E(BD)5,常温下呈液态,熔点为-20.5℃,沸点为103 ℃,易溶于非极性溶剂。
C元素的电离能
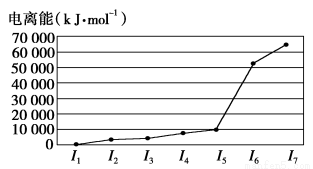
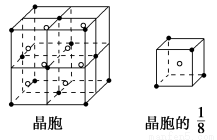
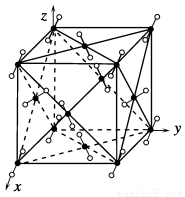
(1)E(BD)5晶体属于________(填晶体类型)。
(2)A元素和B元素组成的化合物分子之间________(填“能”或“不能”)形成氢键。
(3)基态E原子的电子排布式为___________________________________ 。
(4)B、C、D三种元素的电负性由大到小的顺序是________(填元素符号)。
(5)C2和B2A2的分子中根据电子云重叠的方式不同,都包含的共价键类型有________。
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似。根据
下表数据,说明BD分子比C2分子活泼的原因_____________________________。
| X—Y | X=Y | X≡Y |
BD的键能/kJ·mol-1 | 357.7 | 798.9 | 1 071.9 |
C2的键能/kJ·mol-1 | 154.8 | 418.4 | 941.7 |