题目内容
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
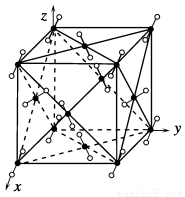
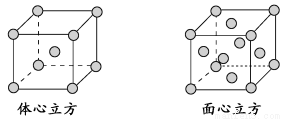
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(1)3d54s2 由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态需要的能量相对要少
(2)①具有孤对电子 ②sp1 N≡N
(3)分子晶体
(4)2∶1
【解析】(1)原子轨道处于全充满或半充满时能量较低,较稳定,故25Mn的价电子排布式为:3d54s2;Fe2+转化为Fe3+时,3d能级由3d6转变为较稳定的半充满状态3d5,而Mn2+转化为Mn3+时,3d能级却由较稳定的半充满状态3d5转变为3d4,所以气态Mn2+再失一个电子比Fe2+难。
(2)①形成配合物的中心原子要能提供空轨道,而配体中的分子或离子应能够提供孤对电子;②配体CN-中碳氮以碳氮叁键相连,为直线形结构,碳原子的杂化轨道类型为sp1;CN-为14电子的离子,故与CO、N2等互为等电子体,但符合题意的是N2(因题中限定为单质分子)。
(3)FeCl3的熔、沸点较低,可知FeCl3晶体为分子晶体。
(4)利用“均摊法”计算,面心立方晶胞中实际含有Fe原子的个数为8×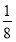 +6×
+6×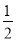 =4,体心立方晶胞中实际含有Fe原子的个数为8×
=4,体心立方晶胞中实际含有Fe原子的个数为8×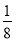 +1=2,故二者原
+1=2,故二者原
子个数之比为2∶1。

 名校课堂系列答案
名校课堂系列答案向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T3 |
反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
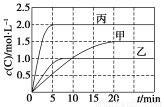
下列说法正确的是( )
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1 ℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%