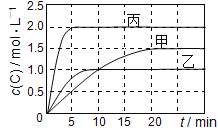
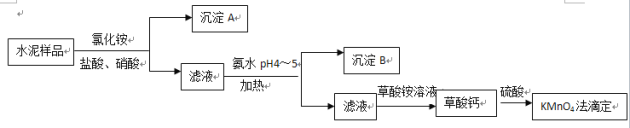
题目内容
【题目】某同学设计如下实验方案,来分离NaCl和BaCl2两种固体混合物,供选试剂:Na2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸

(1)操作②的名称是_______________________
(2)试剂a是__________________,试剂b是____________________
(3) 加入试剂b所发生反应的离子方程式为____________________________________________。
【答案】 过滤 Na2CO3 HCl BaCO3+2H+= Ba2+ +CO2↑+H2O
【解析】分离NaCl和BaCl2两种固体混合物,可先溶于水,然后加入过量Na2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为NaCl和Na2CO3的混合物,蒸发结晶得到固体C为NaCl和Na2CO3,应加入过量盐酸可得NaCl,沉淀A为BaCO3,洗涤后,加盐酸,蒸发得到固体B为BaCl2,
(1)将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作;(2)固体溶解后加入过量Na2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,则试剂a为Na2CO3,试剂b为HCl,固体B为BaCl2;(3)加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液, BaCO3+2H+= Ba2+ +CO2↑+H2O。

【题目】短周期非金属元素甲~丁在元素周期表中的相对位置如下表所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 |
A. 原子半径:甲<乙
B. 原子最外层电子数:甲>丁
C. 原子核外电子层数:丙>甲
D. 元素的最高价氧化物对应水化物的酸性:丁<丙