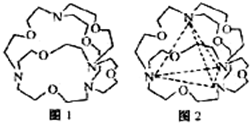
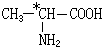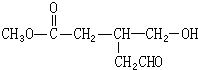题目内容
15.下列说法正确的是( )| A. | 在25℃、1.01×105Pa的条件下,22.4L H2中含有的分子数为0.1NA | |
| B. | 1L 1mol•L-1的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 40g NaOH溶解在1L水中,所制得的100mL溶液中含Na+数为0.1NA | |
| D. | 22g CO2与标准状况下11.2L H2O含有相同分子数 |
分析 A.不是标准状况下,不能使用标准状况下的气体摩尔体积计算;
B.根据n=cV计算出氯化钙的物质的量,再计算出含有的氯离子的物质的量;
C.40g NaOH溶解在1L水中,所得溶液体积不是1L,无法计算100mL溶液中含有的钠离子数目;
D.标准状况下水的状态不是气体.
解答 解:A.25℃、1.01×105Pa的条件下不是标准状况下,不能使用标准状况下的气体摩尔体积计算22.4氢气的物质的量,故A错误;
B.1L 1mol•L-1的CaCl2溶液中含有1mol氯化钙,1mol氯化钙含有2mol氯离子,含Cl-的数目为2NA,故B正确;
C.40g NaOH的物质的量为1mol,1mol氢氧化钠溶解在1L水中所得溶液的体积不是1L,无法计算溶液的浓度,则无法计算100mL该溶液中含有的钠离子数目,故C错误;
D.22gCO2的物质的量为:$\frac{22g}{44g/mol}$=0.5mol,标准状况下H2O不是气体,不能使用标准状况下的气体摩尔体积计算水的物质的量,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等之间的关系为解答关键,注意明确标准状况下气体摩尔体积的使用条件.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目
3.下列说法正确的是( )
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的气体不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同 | |
| D. | 将SO2与Cl2混合后通入品红溶液中漂白效果更好 |
10.设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
| A. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| B. | 乙烯和环丙烷 (C3H6)组成的28 g混合气体中含有3NA个氢原子 | |
| C. | 标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA | |
| D. | 将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1NA个Fe3+ |
7.下列说法正确的是( )
| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取sp3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、C6H6都是只含有极性键的非极性分子 |
5.按微粒半径递增顺序排列的一组原子或离子是( )
| A. | F-、O2-、S2- | B. | O、P、S | C. | K+、Ca2+、Li+ | D. | Al3+、Mg2+、Li+ |
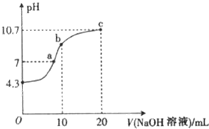 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.