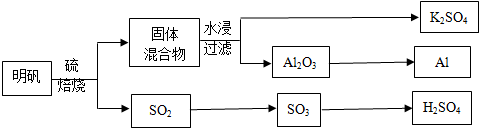
题目内容
2.实验室如何制取Fe(OH)3胶体将饱和三氯化铁溶液滴人沸水中,继续煮沸至溶液呈红褐色,即停止加热,化学反应方程式可表示为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,可用丁达尔效应(方法)证明胶体已经制成.分析 将饱和三氯化铁溶液滴人沸水中来制取氢氧化铁胶体,胶体具有丁达尔效应.
解答 解:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,要注意实验过程不能用玻璃棒搅拌,否则溶液出现浑浊;当反应体系呈现红褐色,即制得氢氧化铁胶体,应立即停止加热,否则也容易出现浑浊,产生红褐色的氢氧化铁沉淀,往沸水中滴加饱和氯化铁溶液后,可稍微加热煮沸,但不宜长时间加热.长时间加热的话就会从胶体变为沉淀;要用蒸馏水,不能用自来水,原理方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,可以用可见光束照射胶体和溶液,出现光亮的通道的是胶体,否则是溶液,利用的是胶体的性质具有丁达尔现象,
故答案为:将饱和三氯化铁溶液滴人沸水中,继续煮沸至溶液呈红褐色,即停止加热,FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,丁达尔效应;
点评 本题考查学生有关胶体的制备和胶体的性质的知识,是对课本知识的考查,较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.(1)管道煤气与天然气是常用的民用燃料.管道煤气的主要成分是CO、H2和少量烃类.天然气的主要成分是CH4.则(1)燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进气口(填“增大”或“减小”),若不作任何改进,可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO.
(2)管道煤气中含有烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是丁烷遇冷凝结为液体使管道内气流不畅.
(2)管道煤气中含有烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
14.化学反应A2+B2=2AB的能量变化如图所示.下列说法正确的是( )
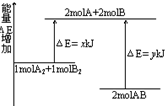

| A. | 该反应是吸热反应 | |
| B. | 生成2molAB需要吸收热量y-x kJ | |
| C. | 断裂1molA-A键和1molB-B键可放出xkJ能量 | |
| D. | 断裂2molA-B键需要吸收ykJ能量 |
11.下列关于化学键的叙述中,正确的是( )
| A. | 离子化合物可能含有共价键 | B. | 共价化合物可能含有离子键 | ||
| C. | 离子化合物只含有离子键 | D. | 以上说法均不正确 |
12.在一个恒温恒容的密闭容器中发生如下反应,2A(g)+2B(s)?C(g)+3D(g),不能说明该反应达到平衡的是( )
| A. | 气体总质量不变 | |
| B. | 反应物B的物质的量浓度不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | 物质C的生成速率和D的消耗速率之比为1:3 |
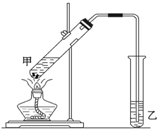 在实验室里用乙醇、冰醋酸和浓硫酸来制备一种有香味的物质,实验装置如图所示,请根据要求作答.
在实验室里用乙醇、冰醋酸和浓硫酸来制备一种有香味的物质,实验装置如图所示,请根据要求作答.