��Ŀ����
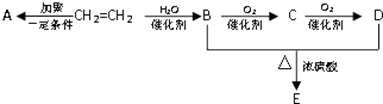
����Ŀ���������ȡ����ͭ������ʾ��ͼ����
��1���������Cu2��OH��2CO3 ������Ӧ�Ļ�ѧ����ʽΪ ��
��2���ڲ���۷����ķ�Ӧ�У�1mol MnO2ת��2mol ���ӣ��÷�Ӧ�����ӷ���ʽΪ ��
��3����С��Ϊ�ⶨ�����������ɣ�����������ʵ�飺a����ȡ4.800g��Ʒ����������ȫ�ܽ�����100.00mL��ҺA��
b����ȡ25.00mL��ҺA������������KI����0.2500molL��1Na2S2O3��Һ���еζ�����Ӧ����ʽΪI2+2Na2S2O3=2NaI+Na2S4O6��������30.00mLNa2S2O3��Һ���յ㣮
b����ȡ25.00mL��ҺA������������NaOH��Һ��ַ�Ӧ���ˡ�ϴ�ӡ����յú�ɫ��ĩ0.600g��
c����ȡ25.00mL��ҺA��������BaCl2��Һ��ַ�Ӧ���ˡ�ϴ�ӡ�����ó���1.165g��
����Na2S2O3��Һ���еζ�ʱ���ζ����յ����ɫ�仯Ϊ �� ��
��ͨ������ȷ����������Ļ�ѧʽ��д��������̣���
���𰸡�
��1��Cu2��OH��2CO3+2H2SO4=2CuSO4+CO2��+3H2O
��2��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
��3���������һ��Na2S2O3��Һʱ����Һ��ɫǡ����ȥ���Ұ�����ڲ��ٻָ���ԭ����ɫ��
�⣺��4.850g��Ʒ��笠����ӵ����ʵ���Ϊn��NH4+�����������������ʵ���Ϊn��OH������
���������غ�ã�4.850g��0.03mol��56g/mol��0.02mol��96g/mol=n��NH4+����23g/mol+n��OH������17g/mol
���ݵ���غ�ã�0.03mol��3+n��NH4+����1=0.02mol��2+n��OH������1
��ã�n��NH4+��=0.01mol��n��OH����=0.06mol��
x��y��m��n=n��NH4+����n��Fe3+����n��SO42������n��OH����=0.01��0.03��0.02��0.06=1��3��2��6��
��ѧʽΪNH4Fe3��SO4��2��OH��6��
�𣺻�������Ļ�ѧʽΪ��NH4Fe3��SO4��2��OH��6
���������⣺��1����ʽ̼��ͭ�����ᷴӦ�ķ���ʽֱ��д���ù۲취��ƽ��Cu2��OH��2CO3+2H2SO4=2CuSO4+CO2��+3H2O�����Դ��ǣ�Cu2��OH��2CO3+2H2SO4=2CuSO4+CO2��+3H2O����2���������������ӱ���������ӣ�1mol MnO2ת�Ƶ���2 mol������Ԫ�ش�+4���+2�ۣ���Һ�������Եģ�����ʽ�����۲��Ҫ���������ӣ��ۺ�����������д�����ӷ���ʽΪMnO2+2Fe2++4H+=Mn2++2Fe3++2H2O�����Դ��ǣ�MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O����2����Na2S2O3��Һ���еζ�ʱ���õ�����ָʾ�������������һ��Na2S2O3��Һʱ����Һ��ɫǡ����ȥ���Ұ�����ڲ��ٻָ���ԭ����ɫ�����Դ��ǣ��������һ��Na2S2O3��Һʱ����Һ��ɫǡ����ȥ���Ұ�����ڲ��ٻָ���ԭ����ɫ����3���йصķ�Ӧ���ӷ���ʽΪ��2Fe3++2I��=2Fe2++I2 �� I2+2Na2S2O3=2NaI+Na2S4O6 �� 2Fe3+��I2��2Na2S2O3n��Fe3+��=2n��I2��=n��Na2S2O3��=0.2500 molL��1��30.00 mL��10��3LmL��1=7.50��10��3 mol����ȡ25.00mL��ҺA������������NaOH��Һ��ַ�Ӧ���ˡ�ϴ�ӡ����յú�ɫ��ĩFe2O30.600g������n��Fe3+��=2��Fe2O3��=2��0.600g/160gmol��1=7.50��10��3 mol�������ڻ��������������+3�ۣ�������BaCl2��Һ��ַ�Ӧ���ˡ�ϴ�ӡ������ó���1.165gΪ���ᱵ��������n��SO42����= ![]() =5.00��10��3mol�� 100 mL��Һ�к���n��Fe3+��=7.50��10��3 mol��
=5.00��10��3mol�� 100 mL��Һ�к���n��Fe3+��=7.50��10��3 mol�� ![]() =0.03 mol��n��SO42����=5.00��10��3 mol��
=0.03 mol��n��SO42����=5.00��10��3 mol�� ![]() =0.02 mol��
=0.02 mol��

 53������ϵ�д�
53������ϵ�д�����Ŀ�����и��������У��������ͼʾ������ͨ��������һ��ת����ϵ�����ֻ�У� ��
��� | X | Y | Z | W |
|
�� | CuO | Cu��OH��2 | CuSO4 | Cu | |
�� | NaCl | NaHCO3 | Na2CO3 | NaOH | |
�� | Cl2 | Ca��ClO��2 | HClO | HCl | |
�� | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
A.�٢ڢ�
B.�٢ۢ�
C.�ڢۢ�
D.�٢ڢ�