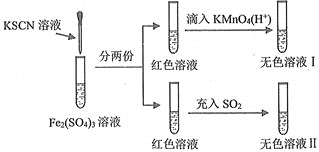
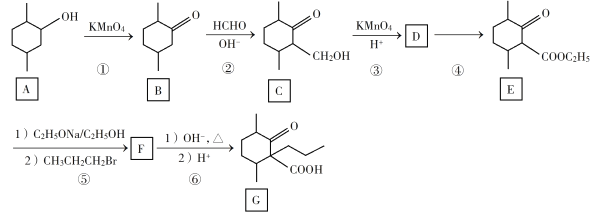
题目内容
【题目】在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:_____________ _____________ _____________
(2)试通过计算确定该钠块中钠元素的质量分数为_________
【答案】Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑ 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑ 89%
【解析】
(1)根据题给信息可知:存在三个反应方程式:Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑,2Al+2NaOH+2H2O = 2NaAlO2+3H2↑;
答案是:Na2O+H2O = 2NaOH,2Na+2H2O = 2NaOH+H2↑, 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑;
(2)n(NaOH) 余=2.0L×0.05 mol·L-1=0.1mol,n(H2)=![]() =0.05 mol,n(Al) =
=0.05 mol,n(Al) =![]() = 0.01mol,由电子守恒知:n(Na)+3n(Al) = 2n(H2),即:n(Na)+3×0.01 mol =2×0.05mol,得:n(Na) =0.07 mol;根据Al守恒,n(NaAlO2)=n(Al)=0.01mol;由钠守恒知:n(NaAlO2)+n(NaOH) =n(Na)+2n(Na2O),即:0.01 mol+0.1 mol =0.07mol+2n(Na2O),得:n(Na2O) =0.02 mol;ω(Na元素) =
= 0.01mol,由电子守恒知:n(Na)+3n(Al) = 2n(H2),即:n(Na)+3×0.01 mol =2×0.05mol,得:n(Na) =0.07 mol;根据Al守恒,n(NaAlO2)=n(Al)=0.01mol;由钠守恒知:n(NaAlO2)+n(NaOH) =n(Na)+2n(Na2O),即:0.01 mol+0.1 mol =0.07mol+2n(Na2O),得:n(Na2O) =0.02 mol;ω(Na元素) =![]() ×100%≈89%;
×100%≈89%;
答案是:89%。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案