题目内容
常温时向某溶液中滴入石蕊试液,溶液呈蓝色,其中可能大量共存的离子是
| A.Ag(NH3)2+、K+、Cl-、OH- | B.S2-、Na+、Cl-、ClO- |
| C.Al3+、K+、SO32-、S2- | D.Fe3+、Na+、Cl-、SO42- |
A
试题分析:某溶液中滴入石蕊试液,溶液呈蓝色,溶液显碱性,A.碱性溶液中该组离子之间不反应,能共存,故A正确;B.S2-、ClO-发生氧化还原反应,则不能共存,故B错误;
C.Al3+分别与SO32-、S2-相互促进水解,Al3+、OH-结合生成沉淀,则不能共存,故C错误;D.Fe3+、OH-结合生成沉淀,则不能共存,故D错误;故选A。

练习册系列答案
相关题目
 、
、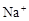 、
、 、
、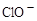
 、
、 、
、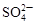 、
、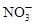
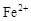 、
、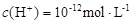 的溶液:
的溶液: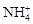 、
、 、
、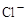 、
、