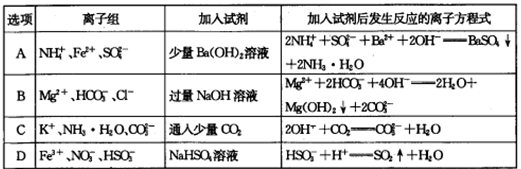
题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙试液显红色的溶液:Na+、NH4+、Fe3+、NO3— |
| B.能使苯酚变紫色的溶液:K+、Mg2+、I-、SO42- |
| C.含Al3+的溶液:NH4+、K+、HCO3-、Cl- |
| D.水电离产生的c(OH-)=1×10-11mol/L的溶液:Cu 2+、SO42-、NO3-、Cl- |
A
试题分析:A、能使甲基橙试液显红色的溶液显酸性:Na+、NH4+、Fe3+、NO3—能大量共存,A正确;B.能使苯酚变紫色的溶液中含有Fe3+ ,能将I-氧化为I2,B错;C.含Al3+的溶液3HCO3-+Al3+=Al(OH)3↓+3CO2↑,C错;D.水电离产生的c(OH-)=1×10-11mol/L的溶液呈碱性,Cu 2++2OH―=Cu(OH)2↓;D错,选A。

练习册系列答案
相关题目