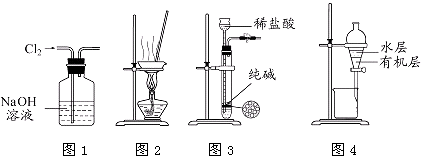
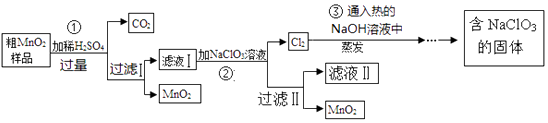
题目内容
【题目】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
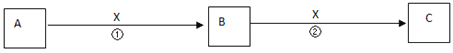
(1)若X是氧气,则A不可能______________A.CB.Si C.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)___________ 。检验B溶液中阳离子的操作方法是_________________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为________________
(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,则反应①的离子方程式为___________________ 。
【答案】 B D FeCl3 2Fe3++Fe═3Fe2+ 向溶液中滴加少量KSCN溶液,呈血红色 Al(OH)3+OH- =AlO2-+2H2O CO32-+H+ = HCO3-
【解析】(1)A、若A为C,C与O2反应生成CO,CO与O2继续反应生成CO2,选项A不选;B、若X为O2,A为Si,Si与O2反应生成SiO2,SiO2与O2不反应,选项B选;C、若A为Na,Na与O2先生成Na2O,Na2O与O2可继续反应生成Na2O2,选项C不选;D、若A为Mg,Mg与O2反应生成MgO,MgO与O2不反应,选项D选;答案选BD;(2)向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,若X是一种金属单质,由转化关系 ,X为变价金属铁,A为强氧化性物质,根据元素守恒知,A是Cl2,B是FeCl3,C是FeCl2;
,X为变价金属铁,A为强氧化性物质,根据元素守恒知,A是Cl2,B是FeCl3,C是FeCl2;
贮存FeCl2溶液时,Fe2+易被氧气氧化生成Fe3+,为防止Fe2+被氧化且不引进新的杂质,应该向氯化亚铁溶液中加入铁粉,2Fe3++Fe═3Fe2+;检验FeCl3溶液中阳离子的操作方法是:向溶液中滴加少量KSCN溶液,呈血红色;(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,A为铝盐,B为Al(OH)3,C为偏铝酸盐;则反应②的离子方程式为: Al(OH)3+OH- =AlO2-+2H2O;(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,A为偏铝酸盐,B为Al(OH)3,C为铝盐;则反应①的离子方程式为CO32-+H+ = HCO3-。

【题目】等质量的 SO2和 SO3相比较,下列结论正确的是( )
A. 它们的分子数目之比是 4:5
B. 它们的氧元素的质量之比为 2:3
C. 它们的物质的量之比为 5:4
D. 它们的密度之比为 5:4
【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
阴离子 | CO32﹣、SiO32﹣、[Al(OH)4]﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
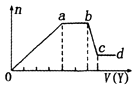
A.若Y是盐酸,则X中一定含有CO32﹣、SiO32﹣、[Al(OH)4]﹣和NH4+
B.若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl﹣
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH﹣═NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4