题目内容
常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.请回答下列问题:
(1)用等式表示Na2CO3溶液中所有阳离子和阴离子浓度的关系:
(2)写出Na2CO3溶液中加入少量盐酸的离子方程式
(3)当混合液的pH=
(4)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7 g时开始产生沉淀X,则KSP(X)=

(1)用等式表示Na2CO3溶液中所有阳离子和阴离子浓度的关系:
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
.(2)写出Na2CO3溶液中加入少量盐酸的离子方程式
CO32-+H+=HCO3-
CO32-+H+=HCO3-
.(3)当混合液的pH=
6
6
时,开始放出CO2气体.(4)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7 g时开始产生沉淀X,则KSP(X)=
8.0×10-9
8.0×10-9
.分析:(1)根据溶液电中性书写离子浓度关系;
(2)Na2CO3溶液中加入少量盐酸生成HCO3-;
(3)当溶液中H2CO3达到饱和后,开始放出CO2气体;
(4)根据KSP(BaCO3)=c(Ba2+)×c(CO32-)计算.
(2)Na2CO3溶液中加入少量盐酸生成HCO3-;
(3)当溶液中H2CO3达到饱和后,开始放出CO2气体;
(4)根据KSP(BaCO3)=c(Ba2+)×c(CO32-)计算.
解答:解:(1)Na2CO3溶液中存在的阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,根据溶液的电中性原则,则有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),
故答案为:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
(2)Na2CO3溶液中加入少量盐酸生成HCO3-,反应的离子方程式为CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
(3)当溶液中H2CO3达到饱和后,开始放出CO2气体,由图象可以看出,当PH=6时,H2CO3达到饱和,开始放出CO2气体,故答案为:6;
(4)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7 g时开始产生沉淀BaCO3,此时:c(CO32-)=0.1mol/L,
c(Ba2+)=
=8.0×10-8,
则:KSP(BaCO3)=c(Ba2+)×c(CO32-)=0.1×8.0×10-8=8.0×10-9
故答案为:8.0×10-9.
故答案为:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
(2)Na2CO3溶液中加入少量盐酸生成HCO3-,反应的离子方程式为CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
(3)当溶液中H2CO3达到饱和后,开始放出CO2气体,由图象可以看出,当PH=6时,H2CO3达到饱和,开始放出CO2气体,故答案为:6;
(4)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7 g时开始产生沉淀BaCO3,此时:c(CO32-)=0.1mol/L,
c(Ba2+)=
| ||
| 0.02L |
则:KSP(BaCO3)=c(Ba2+)×c(CO32-)=0.1×8.0×10-8=8.0×10-9
故答案为:8.0×10-9.
点评:本题考查溶液离子浓度大小比较以及难溶电解质的溶解平衡及沉淀转化等问题,题目难度中等,注意分析图象曲线变化趋势,把握物质的性质.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: H++HA- HA-
H++HA- HA- H++A2-
H++A2- 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存. 含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示。
含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示。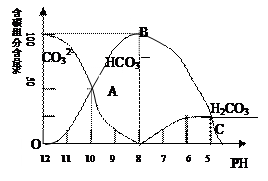

 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。