题目内容
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.(1)现将0.04mol?L-1的HA溶液与0.02mol?L-1的NaOH溶液等体积混合.如HA是
HCN,溶液中c(Na+)>c(CN-),则该混合溶液c(H+)
<
<
c(OH-)(请填“>”“<”或“=”),c(HCN)+c(CN-)=0.02
0.02
mol?L-1.如HA是CH3COOH,该混合溶液呈酸性,c(CH3COOH)
<
<
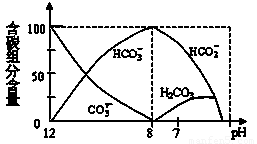
c(CH3COO-)(请填“>”、“<”或“=”).(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示.回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-
不能
不能
(填:“能”或“不能”)大量共存.②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是:
c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)
c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)
.(3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4,当溶c(HCO3-):c(CO32-)=20:1时,溶液的
pH=
9
9
.分析:(1)如HA是HCN,反应后为等浓度的HCN、NaCN的混合溶液,且二者浓度为0.01mol/L,根据溶液呈电中性的角度比较离子浓度大小;根据微粒守恒计算c(HCN)+c(CN-)之和;
如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,且二者浓度为0.01mol/L,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度;
(2)由图象可知,常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,碳酸氢根再与盐酸反应生成碳酸,进而分解产生生成二氧化碳、水,
①H2CO3与CO32-转化为HCO3-;
②由图可知,当pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,根据电荷守恒进行判断;
(3)水解常数Kh=
,当溶c(HCO3-):c(CO32-)=20:1时,根据水解常数计算c(OH-),由根据水的离子积Kw计算c(H+),根据pH=-lgc(H+)计算.
如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,且二者浓度为0.01mol/L,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度;
(2)由图象可知,常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,碳酸氢根再与盐酸反应生成碳酸,进而分解产生生成二氧化碳、水,
①H2CO3与CO32-转化为HCO3-;
②由图可知,当pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,根据电荷守恒进行判断;
(3)水解常数Kh=
| c(HCO3-)?c(OH-) | ||
c(C
|
解答:解:(1)如HA是HCN,反应后为等浓度的HCN、NaCN的混合溶液,且二者浓度为0.01mol/L,
根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),由于c(Na+)>c(CN-),则c(H+)<c(OH-);
根据微粒守恒可知(HCN)+c(CN-)=0.02mol/L;
如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,且二者浓度为0.01mol/L,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度,则c(CH3COOH)<c(CH3COO-),
故答案为:<;0.02;<
(2)由图象可知,常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,碳酸氢根再与盐酸反应生成碳酸,进而分解产生二氧化碳、水,
①由反应及图象可知,在同一溶液中H2CO3与CO32-转化为HCO3-,故H2CO3、HCO3-、CO32-不能大量共存,
故答案为:不能;
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,由电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),
故答案为:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-);
③水解常数Kh=
=2×10-4,当溶液中c(HCO3-):c(CO32-)=20:1时,c(OH-)=10-5mol/L,由水的离子积Kw可知,c(H+)=10-9mol/L,所以pH=-lg10-9=9,
故答案为:9.
根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),由于c(Na+)>c(CN-),则c(H+)<c(OH-);
根据微粒守恒可知(HCN)+c(CN-)=0.02mol/L;
如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,且二者浓度为0.01mol/L,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度,则c(CH3COOH)<c(CH3COO-),
故答案为:<;0.02;<
(2)由图象可知,常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,碳酸氢根再与盐酸反应生成碳酸,进而分解产生二氧化碳、水,
①由反应及图象可知,在同一溶液中H2CO3与CO32-转化为HCO3-,故H2CO3、HCO3-、CO32-不能大量共存,
故答案为:不能;
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,由电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),
故答案为:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-);
③水解常数Kh=
| c(HCO3-)?c(OH-) | ||
c(C
|
故答案为:9.
点评:本题考查离子浓度大小比较、溶液中电解质之间的反应与反应图象、盐类水解计算等,题目难度中等,综合考查学生分析问题、解决问题的能力,注重能力的考查.

练习册系列答案
相关题目

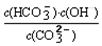 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
 )由大到小的顺序是
)由大到小的顺序是  H++A2-
H++A2-