��Ŀ����
����Ŀ����֪��Һ�У�������IO3��>I2>SO32-����3 mol NaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ������˵����ȷ���ǣ� ��
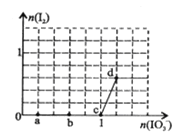
A��a�㷴Ӧ�Ļ�ԭ����NaHSO3����������Ԫ���ǵ�Ԫ��
B��b�㷴Ӧ�����ӷ���ʽ�ǣ�3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C��c�㵽d��ķ�Ӧ�й�ת��0.6mol����
D����200mL 1 mol/L��KIO3��Һ�еμ�NaHSO3��Һ����Ӧ��ʼʱ�����ӷ���ʽ�ǣ�5HSO3-+2IO3- =I2+5SO42-+3H++H2O
���𰸡�D
��������
���������A����NaHSO3����Һ�м���IO3-��Һ����ʼû�в���I2����a�����ȵⷢ����Ӧ��6HSO3-+2IO3- = 6SO42-+2I-+6H+���ڸ÷�Ӧ�л�ԭ����NaHSO3�����б�������Ԫ����SԪ�أ�A�����B��������b��ʱn(IO3-)=0.6mol����Ӧ����HSO3-�����ʵ�����1.8mol�������ķ�Ӧ�ǣ�6HSO3-+2IO3- = 6SO42-+2I-+6H+��B�����C��c�㵽d�����ڷ�Ӧ����I2�������ķ�Ӧ�ǣ�5I-+IO3- +6H+=3I2+3H2O������ͼ���֪����I2�����ʵ�����0.6mol�����ڷ�����Ӧÿת��5mol�ĵ��ӣ�����3mol��I2�����ڲ���0.6mol��I2������һ��ת��1mol���ӣ�C�����D����200mL 1 mol��L��KIO3��Һ�еμ�NaHSO3��Һ�����ڿ�ʼʱKIO3���������Է�����Ӧ6HSO3-+2IO3- = 6SO42-+2I-+6H+��������I-������������ΪI2����˿�ʼʱ�ܷ�Ӧ�����ӷ���ʽ��5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O��D����ȷ����ѡD��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�