题目内容
【题目】(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
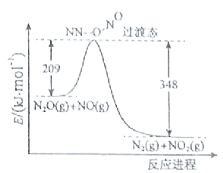
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,△H= kJ·mol-1。
【答案】
(1)NH3·H2O![]() NH4++OH-;降低;增大;
NH4++OH-;降低;增大;
(2)NH4NO3![]() N2O+2H2O;c(N2O)c(H2O)2;4;(3)-139
N2O+2H2O;c(N2O)c(H2O)2;4;(3)-139
【解析】
试题分析:(1)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3H2ONH4++OH-,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,铵根浓度增大,故答案为:NH3H2ONH4++OH-;降低;增大;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3![]() N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol,故答案为:NH4NO3
N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol,故答案为:NH4NO3![]() N2O+2H2O;K=c(N2O)×c2(H2O);4;
N2O+2H2O;K=c(N2O)×c2(H2O);4;
(3)由图可知,此反应反应物总能量高于生成物,且△H=209-348=-139kJmol-1,故答案为:-139。
