题目内容
3.有NH4+、Fe3+、NO3-、Fe2+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物.(1)氧化剂与还原剂的物质的量之比为1:8
(2)若有l mol NO3-参加反应,则转移8mol e-
(3)若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+.
分析 (1)酸性条件下,硝酸根离子具有强氧化性,亚铁离子具有还原性,所以硝酸根离子是氧化剂、亚铁离子是还原剂,根据转移电子守恒计算氧化剂和还原剂的物质的量之比;
(2)该反应中N元素化合价由+5价变为-3价,所以每个N原子转移8个电子;
(3)原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应.
解答 解:(1)酸性条件下,硝酸根离子具有强氧化性,亚铁离子具有还原性,所以硝酸根离子是氧化剂、亚铁离子是还原剂,N元素化合价由+5价变为-3价、Fe元素化合价由+2价变为+3价,根据转移电子守恒知,氧化剂和还原剂的物质的量之比1:8,故答案为:1:8;
(2)该反应中N元素化合价由+5价变为-3价,所以每个N原子转移8个电子,所以若有l mol NO3-参加反应,则转移8mole-,故答案为:8;
(3)原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,所以亚铁离子在负极上失电子发生氧化反应,电极反应式为Fe2+-e-=Fe3+,故答案为:Fe2+-e-=Fe3+.
点评 本题考查氧化还原反应的有关计算,明确元素化合价变化是解本题关键,会根据元素化合价变化确定原电池正负极发生的反应、会判断氧化剂和还原剂,题目难度不大.

练习册系列答案
相关题目
14.可以用分液漏斗进行分离的混合物是( )
| A. | 酒精和碘 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙酸和水 |
8.若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电池的正极上,
②将银片接在电源的正极上,
③在铜片上发生的反应是:Ag++e-═Ag,
④在银片上发生的反应是:4OH--4e-═O2+2H2O,
⑤需用CuSO4溶液,
⑥需用AgNO3溶液作电解液.
①将铜片接在电池的正极上,
②将银片接在电源的正极上,
③在铜片上发生的反应是:Ag++e-═Ag,
④在银片上发生的反应是:4OH--4e-═O2+2H2O,
⑤需用CuSO4溶液,
⑥需用AgNO3溶液作电解液.
| A. | ②③⑥ | B. | ①③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
13.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是( )
| A. | NaNO3 | B. | FeCl2 | C. | Na2SO3 | D. | NaOH |
 +2nH2O.
+2nH2O.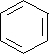 .
. .
.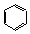 ;CH2=CH2和
;CH2=CH2和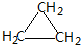 .
.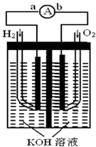 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: