题目内容
18.用下图装置探究Cl2、Br2、I2的活泼性.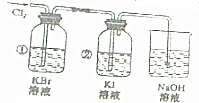
(1)试剂瓶①中现象:无色溶液变为橙(橙黄)色、写出反应方程式Cl2+2KBr=Br2+2KCl.向上述溶液中加入少量CCl4,振荡,溶液分两层,上层无色,下层橙色(或橙红)色.
(2)试剂瓶②中现象:无色溶液变为褐(黄褐)色.写出反应方程式:Cl2+2KI=I2+2KCl.向上述溶液中加入少量CCl4,振荡,溶液分两层,上层无色,下层深紫(紫红)色.
(3)若把溴蒸气通入KI溶液中发生的反应为:Br2+2KI=I2+2KBr
结论:通过以上实验可以得出Cl2、Br2、I2的氧化性强弱顺序是Cl2>Br2>I2.
分析 (1)氯气氧化性大于溴,所以氯气能够与溴化钾溶液反应生成溴单质和氯化钾;加入四氯化碳后发生萃取现象,四氯化碳的溴溶液在下方;
(2)氯气的氧化性大于碘单质,氯气通入碘化钾溶液后发生反应生成碘单质和氯化钾,据此判断反应现象;加入四氯化碳后发生萃取现象,碘的四氯化碳溶液在下方,水层在上方;
(3)溴单质的氧化性大于碘单质,则溴蒸气能够与碘化钾溶液反应生成碘单质和溴化钾,根据以上反应可判断Cl2、Br2、I2的氧化性强弱.
解答 解:(1)由于氯气的氧化性大于溴单质,则试剂瓶①中现象为:无色溶液变为橙(橙黄)色,反应的化学方程式为:Cl2+2KBr=Br2+2KCl;
向上述溶液中加入少量CCl4,振荡,发生萃取现象,则溶液分两层,上层为无色的水层,下层为溴的四氯化碳溶液,为橙色(或橙红色,
故答案为:橙(橙黄);Cl2+2KBr=Br2+2KCl;无;橙色(或橙红);
(2)氯气的氧化性大于碘单质,则试剂瓶②中现象为:无色溶液变为褐(黄褐)色,发生的反应方程式为:Cl2+2KI=I2+2KCl;
向上述溶液中加入少量CCl4,振荡,发生萃取现象,则混合液分两层,上层为无色,下层为碘的四氯化碳溶液,为深紫(紫红)色,
故答案为:褐(黄褐);Cl2+2KI=I2+2KCl;无;深紫(紫红);
(3)溴单质的氧化性大于碘单质,则若把溴蒸气通入KI溶液中发生的反应为为:Br2+2KI=I2+2KBr;
结论:通过以上实验可以得出Cl2、Br2、I2的氧化性强弱顺序是:Cl2>Br2>I2,
故答案为:Br2+2KI=I2+2KBr;Cl2>Br2>I2.
点评 本题考查了卤素单质之间的置换反应,题目难度中等,明确实验目的及发生反应原理为解答关键,注意掌握卤素单质的性质,试题培养了学生的分析、理解能力及化学实验能力.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | CO2 | B. | CO(NH2)2 | C. | C2H2 | D. | NH4HCO3 |
| A. | 蜡烛燃烧 | B. | 花香四溢 | C. | 点石成金 |
| A. | NaAlO2(aq)→Al2O3→Al(OH)3 | B. | N2→NO2→HNO3 | ||
| C. | Na→Na2O2→Na2CO3 | D. | S→SO3→H2SO4 |
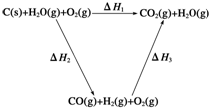 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);