题目内容
【题目】X、Y、Z、W、Q五种元素的原子序数依次增大且分别位于周期表的二、三、四周期,X和Y的原子序数相差1,基态Y原子中有3个未成对电子:基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素;Q位于周期表的第12列。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。
(2)基态X 原子的价层电子排布图为____________。基态W原子中有___________对自旋方向相反的电子。
(3)基态Y原子和基态Z原子的第一电离能:Y___________(填“>”或“<")Z。
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为__________(填分子式)。
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为__________;其酸根离子的空间构型为______。
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为_______________。
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为_____________。若晶体密度为ρg·cm-1,阿伏加德罗常数的值为NA,则晶胞参数为____________nm(用含ρ、NA的代数式表示)。

【答案】 电子云 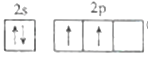 9 > CO:(或CS2或N2O) sp2 平面三角形 NH3为分子晶体,KH为离子晶体,破坏氢键所需能量低于破坏离子键所需能量 4
9 > CO:(或CS2或N2O) sp2 平面三角形 NH3为分子晶体,KH为离子晶体,破坏氢键所需能量低于破坏离子键所需能量 4 ![]() ×107
×107
【解析】X和Y的原子序数相差1,基态Y原子中有3个未成对电子,价电子排布式应为2s23p3,Y为N元素,X为碳元素:基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素,即为前四周期最活泼的金属元素,W为K,Z为S元素;Q应为第四周期元素,位于周期表的第12列,则Q为30号元素Zn;
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述,离核近的区域电子云密度较大,离核远的区域电子云密度较小;
(2)碳的核电荷数为6,基态碳 原子的价层电子排布图为 ;基态K原子的电子排布式为1s22s22p63s23p64s1,共有9对自旋方向相反的电子;
;基态K原子的电子排布式为1s22s22p63s23p64s1,共有9对自旋方向相反的电子;
(3)同一周期元素中,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;同一主族元素,元素电离能随着原子序数增大而减小,所以这几种元素第一电离能大小顺序是N>S;
(4)Fe3+常用KSCN溶液来检验。根据等电子原理,与SCN-互为等电子体的—种分子为CO2、CS2或N2O ;
(5)NO3-中价层电子对个数=3+![]() (5+1-3×2)=3,且不含孤电子对,所以该分子为平面三角形,中心原子采用sp2杂化;
(5+1-3×2)=3,且不含孤电子对,所以该分子为平面三角形,中心原子采用sp2杂化;
(6)NH3为分子晶体,而KH为离子晶体,则NH3的熔点低于KH;
(7)根据硫化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硫原子周围也有4个锌原子,所以硫原子的配位数为4,该晶胞中含有硫原子数为8×![]() +6×
+6×![]() =4,含有锌原子数为4,根据ρ=
=4,含有锌原子数为4,根据ρ=![]() =
=![]() ,所以V=
,所以V=![]() ,则晶胞的边长为
,则晶胞的边长为![]() cm=
cm=![]() ×107pm。
×107pm。

 名校课堂系列答案
名校课堂系列答案






