题目内容
(16分)
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)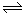 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g)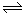 CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)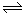 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g)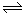 CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律: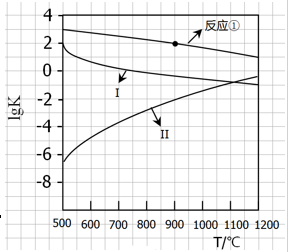
a)
b)
(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900 ºC达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入 。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为 ;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为 。
(1)4△H1+△H2+2△H3;
(2)a)、放热反应的lgK随温度升高而下降; b)、放出或吸收热量越大的反应,其lgK受温度影响越大;
(3)99%
(4)CO2
(5)CaS+2O2 CaSO4,
CaSO4,
解析试题分析:(1)根据盖斯定律可得2 CaSO4(s)+7CO(g)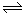 CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=①×4+②+③×2=4△H1+△H2+2△H3;
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=①×4+②+③×2=4△H1+△H2+2△H3;
(2)由图像及反应的△H可知,a)、反应①③是放热反应,随温度升高,lgK降低;反应②是吸热反应,随温度升高,lgK增大;b)、从图像上看出反应②、③的曲线较陡,说明放出或吸收热量越大的反应,其lgK受温度影响越大;
(3)由图可知,反应①于900 ºC的lgK=2,则K=100, c平衡(CO)=8.0×10-5mol·L-1,平衡时c平衡(CO2)=100×8.0×10-5mol·L-1=8.0×10-3mol·L-1,根据反应1/4CaSO4(s)+CO(g)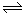 1/4CaS(s)+CO2(g)可知,消耗CO的浓度是8.0×10-3mol·L-1,则开始时c(CO)=8.0×10-5mol·L-1+8.0×10-3mol·L-1=8.08×10-3mol·L-1,所以CO的转化率为8.0×10-3mol·L-1/8.08×10-3mol·L-1×100%=99%,;
1/4CaS(s)+CO2(g)可知,消耗CO的浓度是8.0×10-3mol·L-1,则开始时c(CO)=8.0×10-5mol·L-1+8.0×10-3mol·L-1=8.08×10-3mol·L-1,所以CO的转化率为8.0×10-3mol·L-1/8.08×10-3mol·L-1×100%=99%,;
(4)根据方程式可知,二氧化碳中含有气体杂质SO2,可在CO中加入适量的CO2,抑制二氧化硫的产生;
(5)CaS转化为CaSO4,从元素守恒的角度分析,CaS与氧气发生化合反应,原子的利用率100%,生成CaSO4,化学方程式为CaS+2O2 CaSO4,CO2与对二甲苯发生反应,所得产物中含有羧基,因为苯环的氢原子只有1种,所以产物的结构简式只有1种为
CaSO4,CO2与对二甲苯发生反应,所得产物中含有羧基,因为苯环的氢原子只有1种,所以产物的结构简式只有1种为 。
。
考点:考查盖斯定律的应用,对图像的分析,转化率的计算,化学方程式、结构简式的书写,物质的判断

下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 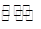 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
(7分)在研究化学反应中的能量变化时,我们通常做下面的实验:
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是_ ② 反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有_③___生成 |
① ② ③
(2)实验中要立即用玻璃棒迅速搅拌的原因是: __________________。(2分)
(3)在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?(2分)
___________________________________________________________。
 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。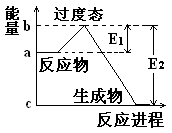
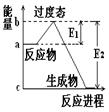
 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.  2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
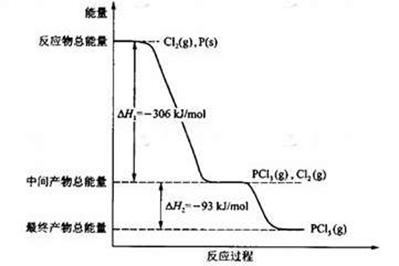
 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为