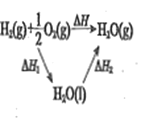题目内容
【题目】在体积为2 L的密闭容器中,充入2mol CO2 和2mol H2,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = _____________;
(2)该反应为____________反应(选填“吸热”或“放热”);
(3)能判断该反应是否达到化学平衡状态的依据是______________;
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ正(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
【答案】![]() 吸热 b 830
吸热 b 830
【解析】
(1)根据化学平衡常数的概念来书写;
(2)根据温度对化学平衡、化学平衡常数的影响来回答;
(3)化学平衡状态的标志:正逆反应速率相等;
(4)根据浓度熵和平衡常数的关系来回答;
(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K =![]() ;
;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热;
(3)a.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a 错误;
b.化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c.化学平衡状态的标志是![]() ,所以
,所以 ![]() 表明反应达到平衡状态,故c错误;
表明反应达到平衡状态,故c错误;
d.![]() 时,没有标明正逆反应速率,不能表明正逆反应速率相等,不一定达到了平衡状态,故d 错误;
时,没有标明正逆反应速率,不能表明正逆反应速率相等,不一定达到了平衡状态,故d 错误;
故选b;
(4)平衡浓度符合下式![]() 时,平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃,故答案为830;
时,平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃,故答案为830;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在2L密闭容器内,800℃时,加入一定量的NO、O2,发生如下反应:2NO(g)+O2(g) ![]() 2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0. 20 | 0. 10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)计算该反应在20秒内用O2表示的反应速率v(O2)= ______________ ;
(2)写出该反应的平衡常数表达式____________。升高温度该反应平衡常数会_______(填“增大”“减小”或“不变”)
(3)下列示意图正确且能说明反应达到平衡状态的是___________

(4)能使该反应的反应速率增大,且NO的平衡转化率也增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知:2NO(g)![]() N2(g)+O2(g) K1=1×1030;2CO2(g)
N2(g)+O2(g) K1=1×1030;2CO2(g)![]() 2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
①2NO(g)+2CO(g) ![]() N2(g)+ 2CO2(g) K=_____________
N2(g)+ 2CO2(g) K=_____________
②仅使用催化剂_______(填“能”或“否”)消除NO、CO污染气体。
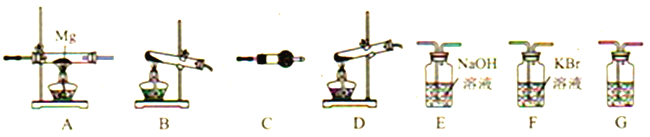
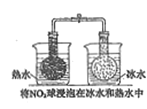
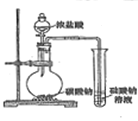
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)=2G(g)忽略固体体积,平衡时G的体积分数![]() 随温度和压强的变化如表所示:
随温度和压强的变化如表所示:
| 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b>f ②915℃,2.0MPa时E的转化率为60% ③该反应的S>0 ④K(1000℃)>K(810℃)。上述中正确的有
A.4个B.3个C.2个D.1个