题目内容
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
(1)写出高氯酸铵分解的化学方程式__________。
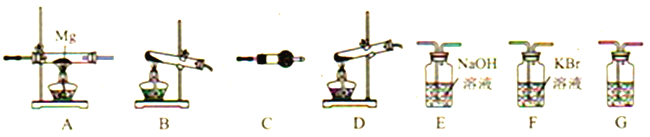
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

【答案】 2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O B CFEGA 无水CuSO4 吸收水(干燥) F中溶液由无色变为橙色(或黄色) 取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色 94%
N2↑+2O2↑+Cl2↑+4H2O B CFEGA 无水CuSO4 吸收水(干燥) F中溶液由无色变为橙色(或黄色) 取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色 94%
【解析】(1) NH4CIO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;反应的化学方程式:2NH4ClO4![]() N2 ↑+2O2↑+Cl2 ↑+4H2O ;正确答案:2NH4ClO4
N2 ↑+2O2↑+Cl2 ↑+4H2O ;正确答案:2NH4ClO4![]() N2 ↑+2O2↑+Cl2 ↑+4H2O。
N2 ↑+2O2↑+Cl2 ↑+4H2O。
(2) 高氯酸铵为固体,且有水产生,因此要用到固+固加热装置,正确答案:B。
(3) 高氯酸铵分解产物中N2、Cl2、O2、H2O;先通过装置C验证水蒸气,然后进入装置F中验证氯气,然后气体进入装置E中,除去氯气,G中装有浓硫酸,进行气体的干燥;最后氮气与镁反应生成氮化镁;装置的连接顺序是:分解装置→C→F→E→G→A;
(4)根据上述分析可知C中所放的试剂是无水CuSO4,检验水蒸气;G中装有浓硫酸,吸收水蒸气;正确答案:无水CuSO4;吸收水。
(5)氯气有氧化性,能够把溴离子氧化为溴单质, F中溶液由无色变为橙色(或黄色),能证明有Cl2产生;正确答案:F中溶液由无色变为橙色(或黄色)。
(6) Mg3N2易水解,与水发生反应生成氢氧化镁和氨气,因此只要检验氨气的存在即可证明装置A中生成了Mg3N2;具体操作为取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色;正确答案:取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色。
(7) NH4ClO4与氢氧化钠反应生成氨气,氨气被过量的硫酸吸收变为硫酸铵,剩余的硫酸用氢氧化钠溶液进行滴定,因此根据酸碱中和规律:溶液中剩余的氢离子的量等于消耗氢氧化钠的量=1×20×10-3=0.02mol,所以用来吸收氨气的氢离子的量为30×1×2 ×10-3-0.02=0.04 mol,所以氨气的量=0.04 mol,高氯酸铵的量=0.04 mol,高氯酸铵的质量=0.04×117.5=4.7g,所以则样品中NH4ClO4的含量(w)为4.7/5×100%=94%;正确答案:94%。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】下表中物质的分类组合正确的是( )
选项 | A | B | C | D |
强电解质 | Al2(SO4)3 | BaSO4 | HF | KClO3 |
弱电解质 | H3PO4 | H2O | CaCO3 | Al(OH)3 |
非电解质 | CO2 | NH3·H2O | NH3 | HI |
A. A B. B C. C D. D

