题目内容
下列有关平衡常数说法正确的是
| A.温度越高,K值越大 |
| B.K值越大,反应的转化率越小 |
| C.K值越大,反应的转化率越大 |
| D.K值的大小与起始浓度有关 |
C
解析试题分析:A.只有对于正向吸热的反应,温度越高,K值越大。A错误; K值越大,反应的转化率越大。B错误,C正确。对于一个确定的反应,K值的大小只与温度有关。D错误。
考点:平衡常数K的影响因素

练习册系列答案
相关题目
处于平衡状态的反应2 H2 S(g)  2H2(g)+S2(g)
2H2(g)+S2(g) 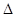 H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,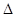 H也将随之改变 H也将随之改变 |
| B.升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C.增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小 |
下列有关说法正确的是
| A.恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变 |
| B.0.1mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
C.对于N2(g)+3H2(g)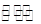 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 |
| D.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
下列事实不能用平衡移动原理解释的是
 | 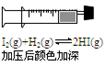     |  | 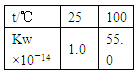 |
| A | B | C | D |
下列有关说法正确的是
| A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液 |
| B.催化剂可以加快化学反应速率但不能改变化学反应的焓变 |
| C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
D.对于反应2SO2(g)+O2(g)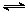 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
下列过程属于熵(S)增加的是 ( )
| A.一定条件下,水由气态变成液态 | B.高温高压条件下使石墨转变成金刚石 |
| C.4NO2(g)+O2(g)=2N2O5 (g) | D.CaCO3(s)=CaO(s)+CO2(g) |
一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积 | B.恒容,充入He | C.恒容,充入O2 | D.恒压,充入N2 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是 ( )。
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
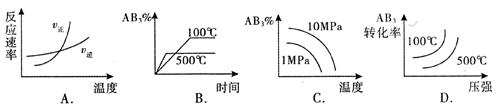
 2A(g) + 3B2(g) △H >0 ,下列图像不正确的是
2A(g) + 3B2(g) △H >0 ,下列图像不正确的是