题目内容
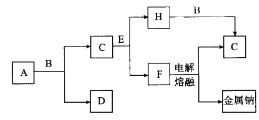
【题目】如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。
(1)化合物A的化学式是_________。
(2)组成单质E的元素在元素周期表中的位置是_________。
H+I反应的化学方程式为___________。
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH=__________。此时再向溶液中通入2.24L化合物A,完生反应后所得溶液的pH<7,用离子方程式表示其原因__________。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为_________。
【答案】(1)NH3;(2)第三周期IVA族;SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(3)1;NH4++ H2O![]() NH3·H2O+H+;(4)H2+2OH--2e-=2H2O
NH3·H2O+H+;(4)H2+2OH--2e-=2H2O
【解析】
试题分析:A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性,则A是氨气;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒,因此二者是CO和NO;根据转化关系图可知B是O2,C是H2,D是CO,单质E可作半导体材料,则E是Si,F是NO,G是H2O,H是C,I是SiO2。
(1)化合物A的化学式是NH3;
(2)组成单质E的元素是14号Si,其在元素周期表中的位置是第三周期第ⅣA族;H+I反应的化学方程式为SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(3)NO、O2在水中发生反应:4NO+3O2+2H2O=4HNO3,n(NO)=2.24L÷22.4l/mol=0.1mol,n(O2)=1.68L
÷22.4L/mol=0.075mol,二者恰好完全反应,产生硝酸的物质的量是0.1mol,由于溶液的体积是1 L,所以c(HNO3)=0.1mol/L,溶液的pH=1;此时再向溶液中通入2.24L化合物 NH3,发生反应:NH3+ HNO3=NH4NO3,得到的是H4NO3。该盐是强酸弱碱盐,NH4+水解消耗水电离产生OH-,促进了水的电离,当最终达到平衡时,c(H+)>c(OH-),所以溶液显酸性,pH<7,离子方程式为NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(4)单质O2和单质H2在一定条件下可组成原电池(用KOH溶液作电解质),通入氢气的电极是负极,在负极发生的电极反应式为H2+2OH--2e-=2H2O。