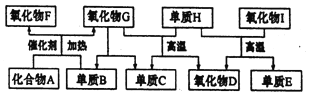
��Ŀ����
����Ŀ����ѧ��ѧ�г����ļ������ʴ�����ͼ��ʾ��ת����ϵ�����У�A��һ�ֺ�ɫ��ĩ״���壬C��һ�ֻ���ɫ���壬ʵ�����г���E��Һ���ն����C��ͼ�в��ֲ���ͷ�Ӧ��������ȥ����
�ش��������⣺
��1��д��A��B��Ũ��Һ��Ӧ�Ļ�ѧ����ʽ��_________��
��2����ag��δA����bmol/L��B��Ũ��ҺcL�м�����ȫ�ܽ⣬��Ӧ��ת�Ƶ���d������NAΪ�����ӵ�������ֵ��NA�ɱ�ʾΪ_____________��
��3����B��Ũ��Һ��H��Ũ��Һ��ϣ�����������������C���÷�Ӧ�����ӷ���ʽΪ_______��
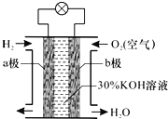
��4��ij����С���ͬѧ��E��Һ����C��������ͼ��ʾװ��������Һ�г���ͨ��SO2���塣
ʵ������й۲쵽��������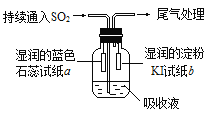
����ʼʱ����Һ�Ϸ����ְ�������ֽa��졣��ͬѧ��Ϊ��HClʹa��죬��ͬѧ��ͬ��Ĺ۵㣬��ͬѧ��Ϊʹa������_______(д��һ�ּ���)��
��Ƭ�̺���Һ�Ϸ����ֻ���ɫ���壬��ֽb�����������ӷ���ʽ����b������ԭ��_____________
��������ֽb��ɫ��ͬѧ����Ϊ���ܵ�ԭ�������֣�һ��I2�л�ԭ�ԣ�����ɫ��������ʽ���������IO3-���Ӷ�ʹ��ɫ��ʧ������_______________��
���𰸡���1��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O(2��)��
MnCl2+Cl2��+2H2O(2��)��
��2��87d/2a(��43.5/d) (2��)��
��3��ClO-+Cl-+2H+=Cl2��+H2O(2��)��
��4����SO2(��H2SO3)(1��)����Cl2+2I-=2Cl-+I2(1��)�����������ԣ�SO2�ܽ�I2��ԭ��I-���Ӷ�ʹ��ɫ��ʧ(2��)
��������
���������C��һ�ֻ���ɫ��������C��������ʵ�����г���E��Һ���ն����C����E������������A��һ�ֺ�ɫ��ĩ״���壬�ܺ�B��Ӧ��������������A�Ƕ������̣�B��Ũ���ᡣ����������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ��F������ڵ��Ȼ��������ƺ����������F���Ȼ��ƣ�H�Ǵ������ƣ��������ƺ����ᷢ��������ԭ��Ӧ����������
��1������������Ũ���ᷴӦ�Ļ�ѧ����ʽΪ MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+ 2H2O��
MnCl2+Cl2��+ 2H2O��
��2����ag��δA����bmol/L��B��Ũ��ҺcL�м�����ȫ�ܽ⣬��Ӧ��Ũ�������������������ȫ��Ӧ������Ӧ��ת�Ƶ���d������NAΪ�����ӵ�������ֵ����![]() �����NA��87d/2a��
�����NA��87d/2a��
��3���������ƾ���ǿ�����ԣ�������������������������Ӧ�����ӷ���ʽΪClO��+ Cl��+ 2H+ ��Cl2 ��+H2O��
��4������ΪSO2����ˮ���������ᣬ��Һ�����ԣ�Ҳ��ʹʪ�����ɫʯ����ֽ�Ժ�ɫ��
��Ƭ�̺���Һ�Ϸ����ֻ���ɫ���壬����������������������ǿ�����ԣ��������⻯�����ɵ��ʵ⣬������������ɫ����Ӧ�����ӷ���ʽΪCl2+2I����2Cl��+ I2��
��������ֽb��ɫ����˵�����ʵⱻ��Ӧ�����ʵ�Ⱦ��������ԣ�Ҳ���л�ԭ�ԡ���SO2���л�ԭ�ԣ��ܰ�SO2�����������ᣬ���SO2��I2��ԭ��I�����Ӷ�ʹ��ɫ��ʧ��