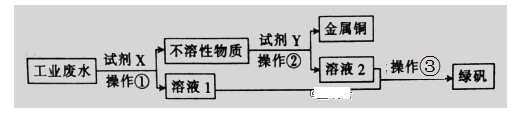
��Ŀ����
����Ŀ�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O(Ħ������376g/mol)��һ���������ռ�������ɫ���壬�ױ����������������ᣬ�����Ҵ���������ˮ�����ѡ����Ʊ�װ��(��ʡ�Լ��ȼ�֧��װ��)�Ͳ�������:
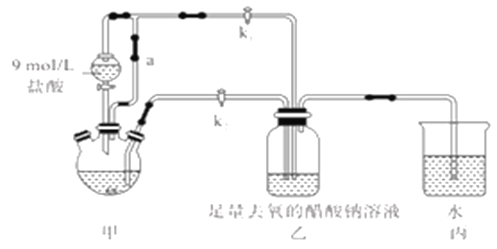
�ټ��װ��������,��������ƿ�����μ������п�ۣ�200mL0.200mol/LCrC13��Һ��
�ڹر�k2��k1,������Һ©�������������ƺõ��١�
�۴�������ƿ�ȵ���Һ������ɫ(Cr3+)��Ϊ����ɫ(Cr2+)ʱ������Һת�Ƶ�װ�����С������ִ�������ɫ����ʱ���رշ�Һ©����������
�ܽ�װ�����л������ٹ��ˡ�ϴ�Ӻ�������õ�11.28g[Cr(CH3COO)2]2��2H2O
��1��װ�ü�����ͨ��a��������________����μ����װ�õ��������Ƿ�����?__________��
��2�����ɺ���ɫ��������ӷ�Ӧ����ʽ____________________________��
��3�����������Һ�Զ�ת����װ�����е�ʵ�����Ϊ________________��
��4��װ�ñ���������________________��
��5��Ϊ�õ���������IJ�Ʒ��ϴ��ʱ��ʹ�õ��Ⱥ�˳��ѡ������ϴ�Ӽ�__________(�����)��
������ ������ˮ(�����ȴ) ����ˮ�Ҵ� ������
��6����ʵ����[Cr(CH3COO)2]2��2H2O�IJ�����______________��
���𰸡�ƽ��ѹǿ��֤��Һ©���е�Һ��˳������ �ر�k1��k2����ֹˮ�м�ס��ͨ��a����Է�Һ©����������һ��ʱ��֮��Һ©����ˮ����˳�����£������������� 2Cr2++4CH3COO��+2H2O�T[Cr(CH3COO)2]22H2O�� �ر�k1����k2 ��ֹ��������װ�����������۸� �ڢ� 75.0%
��������
����ʵ��Ŀ�ļ�ʵ����̣����ʵ��װ��ͼ�ɵã����з�����Ӧ��2CrCl3+Zn=2CrCl2+ZnCl2��Zn+2HCl=ZnCl2+H2�����������������������ѹǿ��ʹ���з�Ӧ�����Һ�������У�������Ӧ��2CrCl2+4CH3COONa+2H2O�T[Cr(CH3COO)2]22H2O��+4NaCl��Ȼ����ˡ�ϴ��������õ�[Cr(CH3COO)2]22H2O���塣
��1��������ƿ���Һ©��֮������ͨ��a���ӣ����������������ƿʱ��ʼ�ձ���������ƿ���Һ©����ѹǿ��ȣ���ƽ��ѹǿ�����ã��Ա�֤��Һ©���е�Һ��˳�����¡����װ�������Ե�ԭ��ͨ�������װ�ò�ͬ��λ�������ѹǿ������������������Լ����װ�õ������Եķ�������Ϊ���ر�k1��k2����ֹˮ�м�ס��ͨ��a����Է�Һ©����������һ��ʱ��֮��Һ©����ˮ����˳�����£���������������
��2������ɫ������CrCl2��CH3COONa��Һ��Ӧ���ɵ�[Cr(CH3COO)2]2��2H2O�����ӷ���ʽΪ��2Cr2++4CH3COO-+2H2O=[Cr(CH3COO)2]22H2O����
��3����ʵ���������������������ѹǿ��ʹ���з�Ӧ�����Һ�������У�������Ӧ���ɴ����Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O�����Բ��������Һ�Զ�ת����װ�����е�ʵ�����Ϊ���ر�k1����k2��
��4�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O�ױ�����������ֱ�ӺͿ����Ӵ�������װ�ñ�������������ֹ��������װ�����������۸���
��5����Ϊ�����Ǹ�ˮ�������������ᣬ�����Ҵ���������ˮ�����ѣ�����ϴ�Ӳ�Ʒ������������Ҵ�������ˮϴȥ��������ӣ���������ϴȥ�����ˮ������ϴ��ʱ��ʹ�õ��Ⱥ�˳��Ϊ���ڢ���
��6��CrC13�����ʵ���Ϊ��0.2L��0.200mol/L=0.04mol������Crԭ���غ㣬[Cr(CH3COO)2]2��2H2O�����۲���Ϊ��376g/mol��0.04mol=15.04g������Ϊʵ�ʲ���Ϊ11.28g�����Ա�ʵ����[Cr(CH3COO)2]2��2H2O�IJ�������11.28g��15.04g��100%=75.0%��

 �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д� �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�