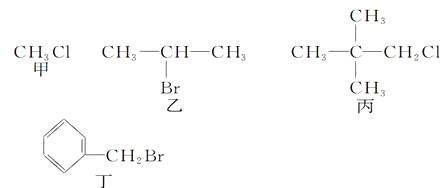
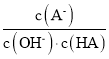题目内容
【题目】如图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: 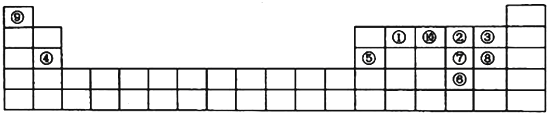
(1)在这10种元素中,非金属性最强的是(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为 , 元素②与⑨形成的18e﹣化合物的电子式;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:>(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式 .
【答案】
(1)③
(2)H﹣O﹣Cl;![]()
(3)离子键和共价键
(4)HCl;H2S
(5)Al2O3+2OH﹣=2AlO2﹣+H2O
【解析】解:由元素在周期表中位置,可知①为C、②为O、③为F、④为Mg、⑤为Al、⑥为Se、⑦为S、⑧为Cl、⑨为H、⑩为N.
(1.)同周期自左而右元素非金属性增强,同主族自上而下元素非金属性减弱,故上述元素中F元素非金属性最强,为③号元素,所以答案是:③;
(2.)元素②⑧⑨以原子个数比1:1:1形成的化合物为HClO,分子中O原子与Cl原子、H原子之间分别形成1对共用电子对,其结构式为H﹣O﹣Cl;
元素②与⑨形成的18e﹣化合物为H2O2 , 分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其电子式为: ![]() ,所以答案是:H﹣O﹣Cl;
,所以答案是:H﹣O﹣Cl; ![]() ;
;
(3.)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3 , 含有离子键、共价键,所以答案是:离子键、共价键;
(4.)同周期自左而右非金属性最强,非金属性越强,氢化物越稳定,故氢化物稳定性:HCl>H2S,所以答案是:HCl>H2S;(5)氧化铝与氢氧化钠反溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH﹣=2AlO2﹣+H2O,所以答案是:Al2O3+2OH﹣=2AlO2﹣+H2O.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将相应的字母序号填入表中的顺序为:
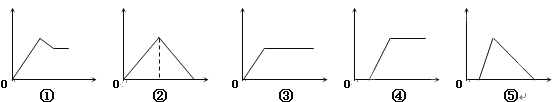
溶 液 | 加入物质 | 答案序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠的溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
A.①③②④⑤ B. ③⑤④②① C. ①②③④⑤ D. ③②④⑤①
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.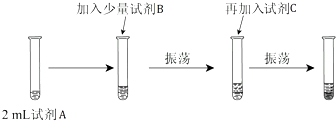
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .