题目内容
【题目】某学生用如图所示装置制取氯气,并收集氯气进行实验。
请完成下列问题:
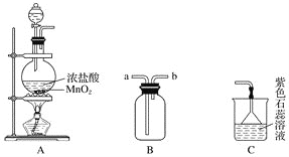
(1)装置A中发生反应的离子方程式为______________________________________。
(2)装置B如图中所示正放,则连接A的接口是________(填序号)。
(3)实验中可观察到装置C中紫色石蕊溶液的现象是__________________,其原因______________________________________________________________________。
(4)取出B中的集气瓶进行氯气与铜的反应实验,应该进行的操作是______________,然后立刻放入充满氯气的集气瓶中。实验中有同学提出应该在集气瓶底先放少量的水或细沙,你认为__________(填“需要”或“不需要”)放,理由是____________________________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O a 先变红,后褪色 氯气与水反应生成盐酸和次氯酸,盐酸使紫色石蕊溶液变红,次氯酸具有强氧化性,使溶液褪色 用坩埚钳夹住一束细铜丝,在酒精灯火焰上灼热 不需要 实验中生成的是烟而不是温度较高的固体熔融物,不会使瓶底炸裂
Mn2++Cl2↑+2H2O a 先变红,后褪色 氯气与水反应生成盐酸和次氯酸,盐酸使紫色石蕊溶液变红,次氯酸具有强氧化性,使溶液褪色 用坩埚钳夹住一束细铜丝,在酒精灯火焰上灼热 不需要 实验中生成的是烟而不是温度较高的固体熔融物,不会使瓶底炸裂
【解析】
(1)实验室利用二氧化锰和浓盐酸加热反应制备氯气生成氯化锰、氯气和水,依据反应写出离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)氯气比空气重,收集气体用向上排气法,导气管长进短出,连接A的导管口是a;
故答案为:a;
(3)C装置用水吸收氯气发生反应,Cl2+H2O=HCl+HClO,盐酸使石蕊试液变红色,次氯酸具有漂白性使石蕊试液褪色;故答案为:先变红,后褪色;原因:氯气与水反应生成盐酸和次氯酸,盐酸使紫色石蕊溶液变红,次氯酸具有强氧化性,使溶液褪色。
(4)进行氯气与铜的燃烧实验:首先进行的操作是用坩埚钳夹住一束铜丝灼烧,然后立刻放入充满氯气的集气瓶中,铜丝燃烧生成棕黄色烟,不是温度较高的固体熔融物,不会炸裂瓶底,集气瓶底不需要放少量的水或细沙,故答案为:用坩埚钳夹住一束细铜丝,在酒精灯火焰上灼热;不需要;实验中生成的是烟而不是温度较高的固体熔融物,不会使瓶底炸裂。