题目内容
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式______.
③配位体CN-的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
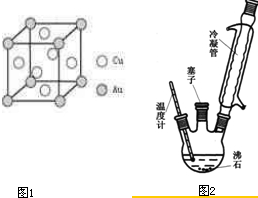
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.

B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
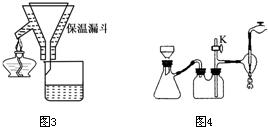
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:

①

②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______.
【答案】分析:A(1)①根据K3[Fe(CN)6的组成元素判断成键特点来判断含有的化学键类型;
②K3[Fe(CN)6中心离子为Fe3+离子,根据能量最低原理可写出电子排布式;
③根据CN-为双原子离子,含有14个电子,以此判断CN-的等电子体;
④用价电子对互斥理论可知二氧化硒分子中含有的价层电子对数和孤电子对数,以此判断分子的立体构型;
(2)①As与Se位于元素周期表中第四周期相邻主族,根据核外电子排布特点比较二者的第一电离能;
②硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键;
B(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管;IBr易发生水解反应;
(2)根据溴化氢易挥发以及使物质充分混合反应的做法来分析;
(3)根据淀粉的特性来选择试剂.
解答:解:A.(1)①K3[Fe(CN)6为离子化合物,应含有离子键,Fe和CN之间为配位键,C与N之间为极性键,
故答案为:CEF;
②Fe的电子排布式为[Ar]3d64S2,则Fe3+离子的电子排布式为:[Ar]3d5,故答案为:[Ar]3d5;
③CN-为双原子离子,含有14个电子,其等电子体有CO、N2,故答案为:CO、N2;
④二氧化硒分子中含有2δ键个,孤电子对数为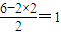 ,分子为V形,故答案为:V形;
,分子为V形,故答案为:V形;
(2)As的价电子排布为4s24p3,而Se的价电子排布为4s24p4,二者相比较,前者p轨道半充满,处于稳定状态,第一电离能较大,硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键,故配位数为4,故答案为:>;4;
B.(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管,不能用碱式滴定管盛装,IBr易发生水解反应,反应方程式为:IBr+H2O=HIO+HBr,故答案为:酸式滴定管(或移液管 );IBr+H2O=HIO+HBr;
(2)溴化氢易挥发,置于暗处可减少溴化氢挥发,为使反应充分进行,应不断搅动使物质充分接触而反应,
故答案为:碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应;
(3)碘遇淀粉变蓝色,可用淀粉为反应的指示剂,滴定时终点的判断为 溶液由蓝色恰好变为无色且30秒内不变化,
故答案为:淀粉溶液;溶液由蓝色恰好变为无色且30秒内不变化.
点评:本题考查配合物知识和实验化学两部分知识,题目较为综合,具有一定难度,做题时注意等电子体以及配位数的判断.
②K3[Fe(CN)6中心离子为Fe3+离子,根据能量最低原理可写出电子排布式;
③根据CN-为双原子离子,含有14个电子,以此判断CN-的等电子体;
④用价电子对互斥理论可知二氧化硒分子中含有的价层电子对数和孤电子对数,以此判断分子的立体构型;
(2)①As与Se位于元素周期表中第四周期相邻主族,根据核外电子排布特点比较二者的第一电离能;
②硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键;
B(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管;IBr易发生水解反应;
(2)根据溴化氢易挥发以及使物质充分混合反应的做法来分析;
(3)根据淀粉的特性来选择试剂.
解答:解:A.(1)①K3[Fe(CN)6为离子化合物,应含有离子键,Fe和CN之间为配位键,C与N之间为极性键,
故答案为:CEF;
②Fe的电子排布式为[Ar]3d64S2,则Fe3+离子的电子排布式为:[Ar]3d5,故答案为:[Ar]3d5;
③CN-为双原子离子,含有14个电子,其等电子体有CO、N2,故答案为:CO、N2;
④二氧化硒分子中含有2δ键个,孤电子对数为
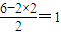 ,分子为V形,故答案为:V形;
,分子为V形,故答案为:V形;(2)As的价电子排布为4s24p3,而Se的价电子排布为4s24p4,二者相比较,前者p轨道半充满,处于稳定状态,第一电离能较大,硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键,故配位数为4,故答案为:>;4;
B.(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管,不能用碱式滴定管盛装,IBr易发生水解反应,反应方程式为:IBr+H2O=HIO+HBr,故答案为:酸式滴定管(或移液管 );IBr+H2O=HIO+HBr;
(2)溴化氢易挥发,置于暗处可减少溴化氢挥发,为使反应充分进行,应不断搅动使物质充分接触而反应,
故答案为:碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应;
(3)碘遇淀粉变蓝色,可用淀粉为反应的指示剂,滴定时终点的判断为 溶液由蓝色恰好变为无色且30秒内不变化,
故答案为:淀粉溶液;溶液由蓝色恰好变为无色且30秒内不变化.
点评:本题考查配合物知识和实验化学两部分知识,题目较为综合,具有一定难度,做题时注意等电子体以及配位数的判断.

练习册系列答案
相关题目
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: 化合物b中进行sp
化合物b中进行sp 3杂化的原子有: .
3杂化的原子有: .
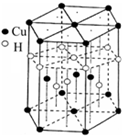
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: (选填序号:a.氯化钠 b.氯化铯 c.石英 d.金刚石).
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为: .
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为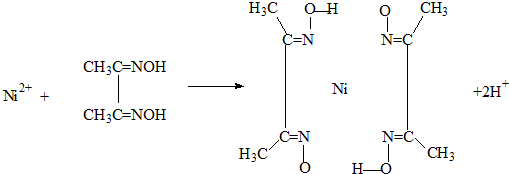
B.4-氯苯胺是合成橡胶、化学试剂、染料、色素等化工产品,制备4-氯苯胺的原理如下:
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
(1)开始时先通入N2的目的是 .
(2)上述实验中过滤的目的是 ,洗涤所用的试剂是 .
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有: 、 .馏出液的主要成分是 .
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
优化的条件是:温度、氢气压力、催化剂用量、吗啉用量,选择的序号依次是 .
A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al
(2)雷尼镍催化的一实例为:
 化合物b中进行sp
化合物b中进行sp 3杂化的原子有:
3杂化的原子有:(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为:
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为

B.4-氯苯胺是合成橡胶、化学试剂、染料、色素等化工产品,制备4-氯苯胺的原理如下:
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.(1)开始时先通入N2的目的是
(2)上述实验中过滤的目的是
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有:
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
| 表1温度 | 表2氢气压力 | 表3催化剂用量 | 表4吗啉用量 | |||||||||||||||
| 序号 | 温度/℃ | 转化率/% | 选择 性/% |
反应时间/h | 序号 | 氢气压力/MPa | 选择性/% | 反应时间/h | 序号 | 雷尼镍用量/g | 选择性/% | 反应时间/h | 序号 | 吗啉用量/% | 选择性/% | |||
| ① | 40 | 未完全 | 99.6 | 6 | ① | 0.5 | 99.6 | 3.7 | ① | 2 | 98.25 | 5 | ① | 0.0 | 84.3 | |||
| ② | 60 | 100 | 99.7 | 4 | ② | 1.0 | 99.7 | 2 | ② | 4 | 99.20 | 2.2 | ② | 0.3 | 99.3 | |||
| ③ | 80 | 100 | 99.6 | 2.45 | ③ | 1.5 | 99.2 | 1.6 | ③ | 6 | 99.60 | 1.9 | ③ | 0.5 | 99.7 | |||
| ④ | 100 | 100 | 99.6 | 2 | ④ | 2.0 | 96.4 | 1.15 | ④ | 8 | 99.60 | 1.4 | ④ | 0.7 | 99.6 | |||
| ⑤ | 120 | 100 | 98.6 | 1.7 | ⑤ | ⑤ | 10 | 99.10 | 1.4 | ⑤ | 1.2 | 99.7 | ||||||
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.