题目内容
【题目】过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下: 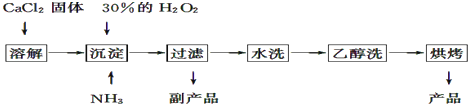
已知CaO28H2O呈白色,微溶于水,不溶于醇类和乙醚等,加热至350℃左右开始分解放出氧气.
(1)用上述方法制取CaO28H2O的化学方程式是;
(2)该制法的副产品为(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是;
(3)检验“水洗”是否合格的方法是;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入适量2molL﹣1的盐酸溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
已知:I2+2S2O32﹣═2I﹣+S4O62﹣
①第一步反应的离子方程式为;
②第三步中盛放Na2S2O3溶液的仪器名称是 , 反应完全时的现象为
③产品中CaO2的质量分数为(用字母表示).
【答案】
(1)CaCl2+H2O2+2NH3+8H2O=CaO28H2O↓+2NH4Cl或CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl
(2)NH4Cl;盐酸
(3)取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀
(4)CaO2+4H++2I﹣═Ca2++2H2O+I2;碱式滴定管;溶液由蓝色变为无色;![]()
【解析】(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO28H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO28H2O↓+2NH4Cl或CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl,故答案为:CaCl2+H2O2+2NH3+8H2O=CaO28H2O↓+2NH4Cl或CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl;(2)根据(1)的反应方程式可知,该制法的副产品为NH4Cl,为了提高副产品的产率,不引入新杂质,结晶前用盐酸将溶液的pH调整到合适范围,故答案为:NH4Cl;盐酸;(3)检验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀, 故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;(4)①在酸性条件下,CaO2能将碘离子氧化成碘单质,反应的离子方程式为CaO2+4H++2I﹣═Ca2++2H2O+I2 , 故答案为:CaO2+4H++2I﹣═Ca2++2H2O+I2;②Na2S2O3溶液呈碱性,所以要用碱式滴定管进行滴定,根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色,反应完全时的现象为溶液由蓝色变为无色,且30s不恢复,故答案为:碱式滴定管;溶液由蓝色变为无色,且30s不恢复;③过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmolL﹣1×V×10﹣3L=cV×10﹣3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32﹣ , 过氧化钙的物质的量为:n(CaO2)= ![]() n(S2O32﹣)=
n(S2O32﹣)= ![]() ×cV×10﹣3mol,样品中CaO2的质量分数为:
×cV×10﹣3mol,样品中CaO2的质量分数为:  ×100%=
×100%= ![]() ×100%=
×100%= ![]() %,故答案为:
%,故答案为: ![]() %.
%.
(1)根据图示流程中找出反应物、生成物,写出反应的化学方程式,由工艺流程可知,反应②为氯化钙与氨水、过氧化氢反应生成CaO28H2O,还应生成氯化铵;(2)根据1)的反应方程式可知,该制法的副产品为氯化铵,为了提高副产品的产率,不引入新杂质,结晶前用盐酸将溶液的pH调整到合适范围;(3)通过检验洗涤液中是否含有氯离子来判断检验“水洗”是否合格;(4)①在酸性条件下,CaO2能将碘离子氧化成碘单质,根据电荷守恒和元素守恒书写离子方程式;②Na2S2O3溶液呈碱性,所以要用碱式滴定管进行滴定,根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;③根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;

 名校课堂系列答案
名校课堂系列答案【题目】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)溴的价电子排布式为;PCl3的空间构型为 .
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生.
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 .
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJmol﹣1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在s﹣pσ键,也不存在p﹣pπ键的是 .
A.HCl
B.HF
C.SO2
D.SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为 , 写出CO的等电子体的微粒(写出1个).
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 .已知该氧化物的密度是ρgcm﹣3 , 则晶胞离得最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).