��Ŀ����
����Ŀ����Ԫ�غ�±��Ԫ�ض����γɶ������ʣ����ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ�����⣮
��1����ļ۵����Ų�ʽΪ��PCl3�Ŀռ乹��Ϊ ��
��2����֪CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ����������� ʽ������
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
��3�������±��ṩ�ĵ�һ�����������жϣ����п������ɽ��ȶ��ĵ��������ӵ�±��ԭ���� ��
�� | �� | �� | �� | |
��һ�����ܣ�kJmol��1�� | 1681 | 1251 | 1140 | 1008 |
��4�����з��ӼȲ�����s��p�Ҽ���Ҳ������p��p�м����� ��
A.HCl
B.HF
C.SO2
D.SCl2
��5����֪COCl2Ϊƽ���Σ���COCl2����̼ԭ�ӵ��ӻ��������Ϊ �� д��CO�ĵȵ����������д��1������
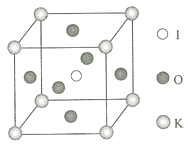
��6������������ȼ��ʱ�õ�һ�ָƵ������ᄃ�壬��ṹ��ͼ��ʾ���ɴ˿��жϸøƵ�������Ļ�ѧʽΪ ����֪����������ܶ��Ǧ�gcm��3 �� �������������������Ӽ�ľ���Ϊ cm��ֻҪ������ʽ�����ؼ������ֵ�������ӵ�����ΪNA����
���𰸡�
��1��4s24p5��������
��2��A
��3����
��4��D
��5��sp2�ӻ���N2
��6�� CaO2��![]()
����������1���崦�ڵ������ڢ�A�壬�۵����Ų�ʽΪ4s24p5��PCl3��Pԭ�ӹµ��Ӷ���= ![]() =1���۲���Ӷ���=3+1=4�����ӿռ乹��Ϊ�����Σ� �ʴ�Ϊ��4s24p5�������Σ���2��CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ����������ӵİ뾶С�ڵ����ӣ�����CsCl�ľ����ܴ���CsI�ľ����ܣ�����ӦCsICl2=CsCl+ICl���У���ѡ��A����3��I�ĵ�һ������ԽС����������γɽ��ȶ��ĵ��������ӣ��ʴ�Ϊ���⣻��4��A�� HCl��Ϊ����������s��p�Ҽ���B��HF��Ϊ����������s��p�Ҽ���C�� SO2�к���˫��������p��p�м���D�� SCl2��Ϊ����������p��p�Ҽ����ʴ�Ϊ��D����5��COCl2Ϊƽ���Σ���ṹʽ��
=1���۲���Ӷ���=3+1=4�����ӿռ乹��Ϊ�����Σ� �ʴ�Ϊ��4s24p5�������Σ���2��CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ����������ӵİ뾶С�ڵ����ӣ�����CsCl�ľ����ܴ���CsI�ľ����ܣ�����ӦCsICl2=CsCl+ICl���У���ѡ��A����3��I�ĵ�һ������ԽС����������γɽ��ȶ��ĵ��������ӣ��ʴ�Ϊ���⣻��4��A�� HCl��Ϊ����������s��p�Ҽ���B��HF��Ϊ����������s��p�Ҽ���C�� SO2�к���˫��������p��p�м���D�� SCl2��Ϊ����������p��p�Ҽ����ʴ�Ϊ��D����5��COCl2Ϊƽ���Σ���ṹʽ�� ![]() ��Cԭ�ӵ��ӻ������ĿΪ3���ӻ�����Ϊsp2�ӻ���CO�ĵȵ��������Ϊ��N2�ȣ��ʴ�Ϊ��sp2�ӻ���N2����6�������и����ӵĸ���Ϊ8��
��Cԭ�ӵ��ӻ������ĿΪ3���ӻ�����Ϊsp2�ӻ���CO�ĵȵ��������Ϊ��N2�ȣ��ʴ�Ϊ��sp2�ӻ���N2����6�������и����ӵĸ���Ϊ8�� ![]() +6��
+6�� ![]() =4���������ӵĸ���Ϊ12��
=4���������ӵĸ���Ϊ12�� ![]() +1=4�����仯ѧʽΪCaO2 �� ��������Ϊ4��
+1=4�����仯ѧʽΪCaO2 �� ��������Ϊ4�� ![]() g���辧���ı߳�Ϊacm����a cm��3����gcm��3=4��
g���辧���ı߳�Ϊacm����a cm��3����gcm��3=4�� ![]() g����a=
g����a= ![]() �������������ĸ���λ�ڶ���������ϵģ����ǵľ���Ϊ�����߳���
�������������ĸ���λ�ڶ���������ϵģ����ǵľ���Ϊ�����߳��� ![]() ����Ϊ
����Ϊ ![]() ��
�� ![]() cm���ʴ�Ϊ��CaO2��
cm���ʴ�Ϊ��CaO2�� ![]() ��
�� ![]() cm����1���崦�ڵ������ڢ�A�壻PCl3��Pԭ�ӹµ��Ӷ���=
cm����1���崦�ڵ������ڢ�A�壻PCl3��Pԭ�ӹµ��Ӷ���= ![]() =1���۲���Ӷ���=3+1=4����2�������Ӿ��������Ӱ뾶ԽС�������������Խ�ߣ�������Խ��3����һ��������ָԭ��ʧȥһ�������������������һ������ԽС����Խ����ʧȥһ�����ӣ���4��s�ܼ���p�ܼ������γɵĹ��ۼ�Ϊs��p�Ҽ���p�ܼ�����֮���γ�˫���������к���p��p�м�����5��COCl2Ϊƽ���Σ���ṹʽ��
=1���۲���Ӷ���=3+1=4����2�������Ӿ��������Ӱ뾶ԽС�������������Խ�ߣ�������Խ��3����һ��������ָԭ��ʧȥһ�������������������һ������ԽС����Խ����ʧȥһ�����ӣ���4��s�ܼ���p�ܼ������γɵĹ��ۼ�Ϊs��p�Ҽ���p�ܼ�����֮���γ�˫���������к���p��p�м�����5��COCl2Ϊƽ���Σ���ṹʽ�� ![]() ��Cԭ�ӵ��ӻ������ĿΪ3���ȵ������Ǿ�����ͬ�ļ۵���������ͬԭ������������6�����ݾ�̯��ȷ�������и���ԭ�ӵĸ�������ȷ���仯ѧʽ�����㾧������������ܶ�ȷ�������������������þ����ı߳��������������ĸ���λ�ڶ���������ϵģ����ǵľ���Ϊ�����߳���
��Cԭ�ӵ��ӻ������ĿΪ3���ȵ������Ǿ�����ͬ�ļ۵���������ͬԭ������������6�����ݾ�̯��ȷ�������и���ԭ�ӵĸ�������ȷ���仯ѧʽ�����㾧������������ܶ�ȷ�������������������þ����ı߳��������������ĸ���λ�ڶ���������ϵģ����ǵľ���Ϊ�����߳��� ![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�