题目内容
【题目】某溶液改变一个条件,酸性一定增大的是
A.酸雨在空气中放置一段时间B.使溶液中c(H+)增大
C.使溶液中c(OH-)减小D.稀盐酸露置于空气中
【答案】A
【解析】
A. 酸雨在空气中放置一段时间会发生反应:2H2SO3+O2=2H2SO4,溶液酸性增强,pH减小,故A符合;
B. 升高温度可以促进水的电离,使溶液中c(H+)增大,但溶液仍为中性,故B不符合;
C. 降低温度可以抑制水的电离,使溶液中c(OH-)减小,但溶液仍为中性,故C不符合;
D. 稀盐酸露置于空气中会挥发出溶质HCl气体,溶液的酸性会减弱,故D不符合;
故答案为A。

 学习实践园地系列答案
学习实践园地系列答案【题目】某化学小组的同学取一定量的Al和Fe2O3的混合物进行铝热反应,并探究熔落物的成分。请回答下列问题:
Ⅰ.(1)引发铝热反应的实验操作是_____________________
(2)做铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是_________________
(3)反应的化学方程式为_____________
Ⅱ.已知:Al、Fe的熔、沸点数据如下:
物质 | Al | Fe |
熔点(℃) | 660 | 1 535 |
沸点(℃) | 2 467 | 2 750 |
(1)某同学猜测,铝热反应所得到的熔落物是铁铝合金。理由:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?____________(填“合理”或“不合理”)。设计一个简单的实验方案,证明上述所得的熔落物中含有金属铝:_____________________
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
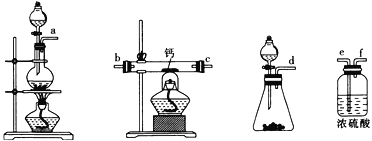
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
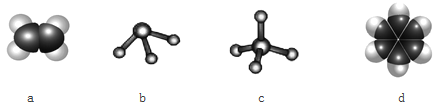
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
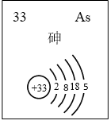
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
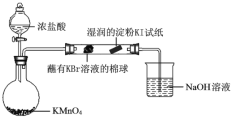
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。