题目内容
电解含下列离子的水溶液,若阴极析出相等质量的金属,则消耗的电量最少的是( )
分析:根据电解原理,水解时阴极发生还原反应,氧化性大于氢离子的金属离子得到电子,被还原成金属单质,根据电子守恒,得到等质量的金属,转移的电子数越多,消耗的电量越大,据此进行分析.
解答:解:设阴极都析出mg金属,转移的电子的物质的量越大,消耗的电量越大,
A、得到mg金属银,转移的电子的物质的量的为:
mol,
B、得到mg铜,转移的电子的物质的量为:
×2mol=
mol,
C、钠离子在溶液中无法得到金属钠单质,
D、电解含有镁离子的溶液无法得到金属镁,
所以析出相等质量的金属,则消耗的电量最少的是A,
故选:A.
A、得到mg金属银,转移的电子的物质的量的为:
| m |
| 108 |
B、得到mg铜,转移的电子的物质的量为:
| m |
| 64 |
| m |
| 32 |
C、钠离子在溶液中无法得到金属钠单质,
D、电解含有镁离子的溶液无法得到金属镁,
所以析出相等质量的金属,则消耗的电量最少的是A,
故选:A.
点评:本题考查了电解原理,注意熟练掌握离子的放电顺序,合理分析电极反应及生成物,本题难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


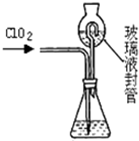 Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
 A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M.
A、B、C、D、E、F为原子序数依次增大的六种短周期元素.A、D处于同一主族,D、E、F处于同一周期,F原子的最外层电子数是A、B、D原子最外层电子数之和.C2-与D+核外电子层结构相同.A、B组成的常见气体X能使湿润的红色石蕊试纸变蓝;F的单质与X反应能生成B的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;E的单质既能与D元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐N;D、F可组成化合物M.