题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.已知N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol,在该反应中,当有3NA个电子转移时,上述热化学方程式的焓变变为:△H=-46.2kJ/mol 2NH3(g) △H=-92.4kJ/mol,在该反应中,当有3NA个电子转移时,上述热化学方程式的焓变变为:△H=-46.2kJ/mol |
| B.标准状况下,22.4L空气含有的气体分子总数为NA |
| C.1L0.1mol/L的CH3COOH溶液中含有CH3COOˉ为0.1NA |
| D.1molFe与足量的稀硝酸充分反应,转移的电子数目为2NA |
B
解析试题分析:根据化合价升降总数等于转移电子数可得:N2(g)+3H2(g)  2NH3(g)~6 eˉ,如果转移的n(eˉ)=3mol,则参加反应的氮气的物质的量减半,但是热化学方程式中氮气的系数并没有减半,所以该反应的焓变也不会减半,△H仍为-92.4kJ/mol,故A错误;n(空气)=22.4L÷22.4L/mol=1mol,空气是由各种气体分子组成的混合物,则气体分子总的物质的量为1mol,故B正确;虽然n(CH3COOH)=0.1mol/L×1L=0.1mol,但是醋酸是弱酸,醋酸溶于水时不能完全电离为醋酸根离子,则n(CH3COOˉ)<0.1mol,故C错误;硝酸具有强氧化性,能将少量的铁单质氧化为铁盐,即Fe+4HNO3==Fe(NO3)3+NO↑+2H2O~3eˉ,根据系数之比等于物质的量之比可知,1molFe完全反应转移3mol电子,故D错误。
2NH3(g)~6 eˉ,如果转移的n(eˉ)=3mol,则参加反应的氮气的物质的量减半,但是热化学方程式中氮气的系数并没有减半,所以该反应的焓变也不会减半,△H仍为-92.4kJ/mol,故A错误;n(空气)=22.4L÷22.4L/mol=1mol,空气是由各种气体分子组成的混合物,则气体分子总的物质的量为1mol,故B正确;虽然n(CH3COOH)=0.1mol/L×1L=0.1mol,但是醋酸是弱酸,醋酸溶于水时不能完全电离为醋酸根离子,则n(CH3COOˉ)<0.1mol,故C错误;硝酸具有强氧化性,能将少量的铁单质氧化为铁盐,即Fe+4HNO3==Fe(NO3)3+NO↑+2H2O~3eˉ,根据系数之比等于物质的量之比可知,1molFe完全反应转移3mol电子,故D错误。
考点:考查阿伏加德罗常数,涉及转移电子数、气体摩尔体积、物质的量浓度、物质的量等的计算,以及可逆反应、弱电解质的电离平衡、氧化还原反应等知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
A.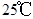 时,1g水中约含有6.02×1013个OH- 时,1g水中约含有6.02×1013个OH- |
B.在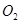 参与的反应中, 参与的反应中,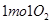 作氧化剂时得到的电子数一定是 作氧化剂时得到的电子数一定是 |
| C.1.8g重水(D2O)中含NA个质子和NA个中子 |
| D.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA |
若NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol氦气分子中含2NA个氦原子 |
| B.在0℃、101kPa时,22.4L氢气中含有NA个氢原子 |
| C.在标准状况下,22.4L空气中约有NA个气体分子 |
| D.25℃时,l L pH=13的Ba(OH)2溶液中含 Ba2+的数目为0.1NA |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.16g CH3OH中含有2nA个共价键 |
| B.1 mol?L-1CuCl2溶液含有2nA个Cl- |
| C.1 mol Fe与足量的C12反应,转移3nA个电子 |
| D.常温常压下,22.4L CH4中含有nA个CH4分子 |
下列化学用语的书写正确的是( )
| A.乙酸的分子式:C2H4O2 |
| B.乙烯的结构简式 C2H4 |
C.F原子结构示意图: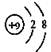 |
D.四氯化碳的电子式: |
以NA表示阿伏加德罗常数,下列说法中正确的是
| A.在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 |
| B.0.1mol·L-1氯化钡溶液中Cl-数是0.2NA |
| C.18gD2O所含电子数目为10NA(相对原子质量:O-16) |
| D.4g氦气所含分子数为NA(相对原子质量:He-4) |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温下,18g H2O中含H2数目为NA |
| B.标准状况下,22. 4LH2O中含有化学键的数目为2NA |
| C.将0.5mol SO2通入足量水中,充分反应后可得到H2 SO3分子数为0.5NA |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4 NA |
下列化学用语正确的是
A.亚硫酸氢钠溶液显酸性的原因是:HSO3-+H2O H3O++SO32- H3O++SO32- |
B.氯化铵的电子式为: |
C.钠离子的离子结构示意图为:Na  |
D.水分子比例模型为: |