题目内容
【题目】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为________________。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
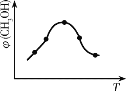
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应热△H3_____0(填“>”“<”或“=”),该反应的平衡常数表达式为_______________。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:

0~10 min内,氢气的平均反应速率为 ___________________mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数____________ (填“增大”“减小”或“不变”,下同),反应的平衡常数_____________________。
(3)脱硫。
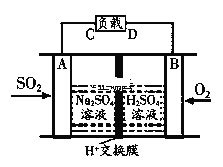
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。AB是惰性电极,A极的电极反应式为:_________。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为_________。
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
【答案】CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=867kJ/mol < ![]() 0.225 变大 不变 SO22e+2H2O=4H++SO42 B
0.225 变大 不变 SO22e+2H2O=4H++SO42 B
【解析】
(1)依据热化学方程式和盖斯定律计算得到;
(2)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
②先根据图表,利用v=![]() 计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;化学平衡常数只受温度的影响;
计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;化学平衡常数只受温度的影响;
(3)①SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应;
②硝酸铵是强酸弱碱盐,由于NH4+水解,因铵盐要发生水NH4++H2ONH3H2O+H+,导致溶液中c(NH4+)<c(NO3),根据加入的物质对铵根离子水解平衡的影响进行分析;
(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=574kJmol1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=1160kJmol1
由盖斯定律(①+②)×![]() 得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=867kJ/mol,
得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=867kJ/mol,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=867kJ/mol;
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数为K=![]() ,
,
故答案为:<;![]() ;
;
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L0.25mol/L=0.75mol/L,所以10min内,v(CO2)=![]() =0.075mol/(Lmin),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(Lmin)=0.225mol/(Lmin),第10min后,向该容器中再充入1molCO2和3molH2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大,化学平衡常数只受温度的影响,故化学平衡常数不变,
=0.075mol/(Lmin),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(Lmin)=0.225mol/(Lmin),第10min后,向该容器中再充入1molCO2和3molH2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大,化学平衡常数只受温度的影响,故化学平衡常数不变,
故答案为:0.225;变大;不变;
(3)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,则A为负极,A电极发生的反应为:SO22e+2H2O=4H++SO42,
故答案为:SO22e+2H2O=4H++SO42;
②硝酸铵是强酸弱碱盐,由于NH4+水解,因铵盐要发生水NH4++H2ONH3H2O+H+,导致溶液中c(NH4+)<c(NO3)。
A. 加入硝酸,氢离子的浓度增大能抑制铵根离子的水解,但硝酸中有硝酸根离子导致硝酸根离子的浓度增大,c(NH4+)<c(NO3),故A错误;
B. 加入氨水使溶液的PH=7,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,溶液中阴阳离子所带的电荷相等,所以c(NH4+):c(NO3)=l:l,故B正确;
C. 加入适量的NaOH,使溶液的pH=7,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,溶液中阴阳离子所带的电荷相等,[c(NH4+)+C(Na+)]:c(NO3)=l:l,所以c(NH4+):c(NO3)小于l:l,故C错误;
D. 再加入适量的NH4NO3,不能抑制铵根离子的水解,仍存在c(NH4+):c(NO3)小于l:l,故D错误;
故答案选B。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下:

原理:反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知:25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。
(2)步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。
(3)流程中可循环利用的物质主要是_________(写化学式)。
(4)忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。
(5)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。记录实验数据如表
实验次数 | V1(滴定前读数/mL) | V2(滴定后读数/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
已知:2MnO4﹣+ 5C2O42﹣+16H+ =2Mn/span>2++ 10CO2↑+ 8H2O,则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。