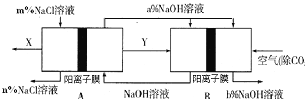
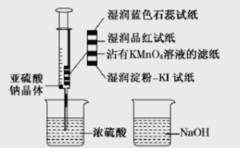
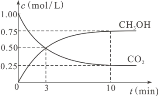
题目内容
【题目】氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O
(1)Ni2+基态核外电子排布式为________。
(2)CH3NC(其结构简式为CH3- N ![]() C)分子中碳原子轨道的杂化类型是_____;1molCH3NC中σ键的数目为_______。
C)分子中碳原子轨道的杂化类型是_____;1molCH3NC中σ键的数目为_______。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。
①与COCl2互为等电子体的一种阴离子为___。
②甲胺极易溶于水,除因为它们都是极性分子外,还因为___。
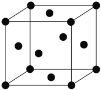
(4)Ni单质的晶胞结构如下图所示,晶体中每个Ni原子周围与之距离最近的原子个数为______。
【答案】[Ar]3d8 SP3 杂化、SP 杂化 5mol NO3- 或CO32- 甲胺与水形成分子间氢键 12
【解析】
(1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+;
(2)根据CH3N![]() C中碳原子形成的价层电子对数判断杂化轨道形式;单键均为σ键,叁键中含有1个σ键,2个π键;
C中碳原子形成的价层电子对数判断杂化轨道形式;单键均为σ键,叁键中含有1个σ键,2个π键;
(3)①原子数和价电子数都相等的微粒互为等电子体;
②分子间存在氢键溶解性增强;
(4)晶胞中顶点Ni原子与面心Ni原子间距离最短。
(1) Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+,Ni2+离子核外电子排布式为:1s22s22p63s23p63d8,所以Ni2+基态核外电子排布式为[Ar]3d8;
(2) CH3NC中甲基上的碳形成的价层电子对数为4,无孤对电子,则为sp3 杂化,而碳氮叁键中的碳形成的价层电子对数为2,则为sp杂化,单键均为σ键,叁键中含有1个σ键,则1molCH3NC中σ键的5mol;
(3)①原子数和价电子数都相等的微粒互为等电子体,与COCl2互为等电子体的阴离子的化学式为CO32-或NO3-;
②水是极性溶剂,而甲胺是极性分子,且能与水形成分子间氢键,所以甲胺极易溶于水;
(4) 晶胞中顶点Ni原子与面心Ni原子间距离最短,则晶体中每个Ni原子周围与之距离最近的原子个数为8×3×![]() =12。
=12。