��Ŀ����
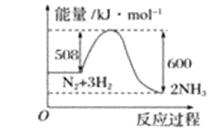
����Ŀ����Դ����������ͷ�չ����Ҫ֧�����о�����Ч�ؿ�������Դ����Դ��ȱ�Ľ��������Ҫ���������塣��֪H2��CO��Ӧ����CH3OH�Ĺ�����ͼ��ʾ��
CO��ȼ������H2����b kJ/mol��CH3OH��ȼ������H3����c kJ/mol�������������Ϣ���ش������й����⣺
��1���״���һ��______(������������������)������Դ���״��Ĺ����ŵĵ���ʽ��____________��
��2��CH3OHȼ���ȵ��Ȼ�ѧ��Ӧ����ʽΪ___________________________________��
��3��H2��ȼ������H=_______________________��
��4��һЩ��ѧ���������£�C��OΪd kJ/mol��O=OΪekJ/mol��C=OΪfkJ/mol�����������������b=_______(��d��e��f�Ĵ���ʽ��ʾ)��
��5��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g)![]() CH3OH(g) ��H����d kJ/mol����һ���¶��£���1mol CO(g)��2molH2(g)���뵽���Ϊ10L���ܱ������У�������Ӧ������5min�ﵽƽ������ʱ������ѹǿΪ��Ӧǰ��0.8�������ʱv����CH3OH��Ϊ____________������Ӧ�ų�������Ϊ__________________��CO��ת����Ϊ___________��
CH3OH(g) ��H����d kJ/mol����һ���¶��£���1mol CO(g)��2molH2(g)���뵽���Ϊ10L���ܱ������У�������Ӧ������5min�ﵽƽ������ʱ������ѹǿΪ��Ӧǰ��0.8�������ʱv����CH3OH��Ϊ____________������Ӧ�ų�������Ϊ__________________��CO��ת����Ϊ___________��
��6��úȼ�յ�����(��Ҫ��Ⱦ��SO2��NOx)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪNO(g)��O3(g)=NO2(g)��O2(g) ��H����200.9kJ/mol��NO(g)��1/2O2(g)=NO2(g) ��H����58.2kJ/mol��SO2(g)��O3(g)=SO3(g)��O2(g) ��H����241.6kJ/mol����Ӧ3NO(g)��O3(g)==3NO2(g)����H��________kJ/mol��
���𰸡���![]() CH3OH(l)+3/2 O2(g)=CO2(g)+H2O(l) ��H=-ckJmol-1_ 1/2(a+c-b)kJmol��12f-d-0.5e0.006mol��L��1��min��10.3d kJ30%-317.3
CH3OH(l)+3/2 O2(g)=CO2(g)+H2O(l) ��H=-ckJmol-1_ 1/2(a+c-b)kJmol��12f-d-0.5e0.006mol��L��1��min��10.3d kJ30%-317.3
��������
(1)�״���һ�ֿ�������Դ���״��Ĺ��������ǻ����ʵ����ԣ�����ʽΪ��![]() ���ʴ�Ϊ���ɣ�
���ʴ�Ϊ���ɣ�![]() ��
��
(2)CH3OH��ȼ������H3=-ckJmol-1��ȼ������1mol��ȼ����ȫȼ�������ȶ�������ų�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH3OH(l)+![]() O2(g)��CO2(g)+2H2O(l) ��H=-ckJmol-1���ʴ�Ϊ��CH3OH(l)+
O2(g)��CO2(g)+2H2O(l) ��H=-ckJmol-1���ʴ�Ϊ��CH3OH(l)+![]() O2(g)��CO2(g)+2H2O(l) ��H=-ckJmol-1��
O2(g)��CO2(g)+2H2O(l) ��H=-ckJmol-1��
(3)��2CH3OH(l)+3O2(g)��2CO2(g)+4H2O(l) ��H=-2ckJmol-1����2CO(g)+O2(g)=2CO2(g) ��H=-2bkJmol-1����2H2(g)+CO(g)=CH3OH(l)��H=-a kJ��mol-1�����ݸ�˹���ɣ�����2-��+�ٵõ���4H2(g)+2O2(g)=4H2O(l)��H=-(2a-2b+2c)kJ��mol-1������������ȼ������1mol������ȫȼ������Һ̬ˮ�ų���������������ȼ������H =-![]() kJ��mol-1���ʴ�Ϊ��-
kJ��mol-1���ʴ�Ϊ��-![]() kJ��mol-1��
kJ��mol-1��
(4)һЩ��ѧ���������£�C��OΪd kJ��mol-1��O=OΪe kJ��mol-1��C=OΪf kJ��mol-1��
��ӦΪ��2CO(g)+O2(g)=2CO2(g)��H=-2bkJmol-1����Ӧ���ʱ�=��Ӧ��ļ���֮��-������ļ���֮��=2d+e-2��f��2=��H=-2b��b=2f-d-![]() ���ʴ�Ϊ��2f-d-
���ʴ�Ϊ��2f-d-![]() ��
��
(5)��ת����CO�����ʵ���Ϊx
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ(mol) 1 2 0
��Ӧ(mol) x 2x x
ƽ��(mol) 1-x 2-2x x
��ͬ�¶�ʱ�������ѹǿ�����ʵ��������ȣ���![]() =0.8����ã�x=0.3mol��ƽ��ʱ��v��(CH3OH)=
=0.8����ã�x=0.3mol��ƽ��ʱ��v��(CH3OH)=![]() = 0.006mol��L��1��min��1������Ӧ�ų�������Ϊd kJ/mol��0.3mol= 0.3d kJ��CO��ת����Ϊ
= 0.006mol��L��1��min��1������Ӧ�ų�������Ϊd kJ/mol��0.3mol= 0.3d kJ��CO��ת����Ϊ![]() ��100%=30%���ʴ�Ϊ��0.006mol��L��1��min��1��0.3d kJ��30%��
��100%=30%���ʴ�Ϊ��0.006mol��L��1��min��1��0.3d kJ��30%��
(6)��NO(g)+O3(g)�TNO2(g)+O2(g)��H=-200.9kJ��mol-1����NO(g)+![]() O2(g)�TNO2(g) ��H=-58.2kJ��mol
O2(g)�TNO2(g) ��H=-58.2kJ��mol

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���Է�Ӧ5H2C2O4+2MnO4-+6H+===10CO2��+2Mn2++8H2OΪ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ������ʵ��ʱ���ֱ���ȡH2C2O4��Һ������KMnO4��Һ��Ѹ�ٻ�ϲ���ʼ��ʱ��ͨ���ⶨ��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�����
��� | H2C2O4��Һ | ����KMnO4��Һ | �¶�/�� | ||
Ũ��/mol��L-1 | ���/mL | Ũ��/mol��L-1 | ���/mL | ||
�� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
����˵������ȷ����
A. ʵ��������������ӵ�H2C2O4��Һ��Ҫ����
B. ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ40 s�������ʱ����ƽ����Ӧ������(KMnO4)=2.5��10-4mol��L-1��s-1
C. ������a L CO2����״�������÷�Ӧת�Ƶĵ�����ΪaNA/22.4
D. ʵ��ٺ͢������Ӧ������������һ�������ͻȻ�����������ɵ�Mn2+�Է�Ӧ�������
����Ŀ��±�����Ҫ�ɷ���MgCl2�������Fe3����Fe2����Mn2�������ӵ������Ρ���±��Ϊԭ�Ͽ��Ƶ���������þ������������ͼ��
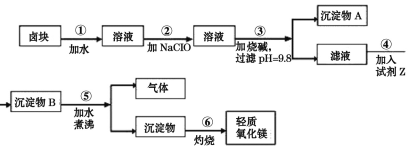
��֪����1��Fe2�������������״�����״���Һ�г�ȥ������������ΪFe3��������Fe��OH��3������ȥ��
��2��ԭ�ϼ۸��
���� | �۸�/(Ԫ������1) |
ƯҺ����25.2%NaClO�� | 450 |
˫��ˮ����30%H2O2�� | 2400 |
�ռ��98%NaOH�� | 2100 |
�����99.5%Na2CO3�� | 600 |
��3�������������������PH
���� | ��ʼ���� | ������ȫ |
Fe��OH��3 | 2.7 | 3.7 |
Fe��OH��2 | 7.6 | 9.6 |
Mn��OH��2 | 8.3 | 9.8 |
Mg��OH��2 | 9.6 | 11.1 |
�ش��������⣺
��1��ij������ȤС�����ʵ��֤��±���к���Fe3��Ϊ��ȡ������Ʒ��ˮ�ܽ⣬____����˵��±���к�Fe3����
��2����ҵ��ұ��þ���õķ����Ļ�ѧ����ʽΪ____��
��3������ڼ���NaClO������H2O2��ԭ����____������ڷ�Ӧ������������ɫ�������÷�Ӧ���������뻹ԭ���ı���Ϊ____��
��4������A����Ҫ�ɷ�Ϊ____������ܼ��������Ϊ____��
��5������ݷ����ķ�Ӧ�Ļ�ѧ����ʽΪ____��
��6�����������ʵ���ҽ��У�Ӧѡ����____�����������ƣ������ա�