题目内容
(本题16分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下:

(1)氯化炉中通入O2的目的是 _________。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是____________________________。
(3)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式___________________________________________________。
(4)在升华器中加入铝粉的目的是_________________________________________。
(5)用氯化铝晶体(AlCl3·6H2O)在HCl气中加热也能进行无水氯化铝的制备。但若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
(6)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为___________________________________。

(1)氯化炉中通入O2的目的是 _________。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是____________________________。
(3)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式___________________________________________________。
(4)在升华器中加入铝粉的目的是_________________________________________。
(5)用氯化铝晶体(AlCl3·6H2O)在HCl气中加热也能进行无水氯化铝的制备。但若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
(6)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为___________________________________。
(1)与C反应,提供反应所需的热量 (2分)
(2)Al2O3+3Cl2+3C = 2AlCl3+3CO (800 ℃)(3分)
(3)SO32-+Cl2+H2O=SO42-+2H++2Cl- (3分)
(4)将FeCl3杂质还原成Fe除去 (2分)
(5)4 (3分)
(6)Al-3e-+4Cl-= AlCl4-(3分)
试题分析:工艺流程题要弄清原料及成分、所要制备的产品,给出的已知条件也是常设问题的地方要十分注意。
(1)通入氧气的目的,通氧气后出来的产物就可以知道是和碳反应,除此以外就是反应放热为其它反应提供能量。
(2)根据箭头的指向,C被还原成CO,氯气被还原成AlCl3,所以C+Al2O3+Cl2→CO+AlCl3
然后再利用氧化还原反应的配平方法进行配平。
(3)利用的是亚硫酸钠的还原性,氯气的氧化性,在溶液中亚硫酸根被氧化后生成硫酸根离子,氯气单质被还原后则是氯离子,写方程式时可以先写SO2+ Cl2→2Cl—+SO42—再根据电原子守恒和电荷守恒,在边补上水,右边补上氢离子,配平就可以了。
(4)由“升华器”处可知,要将铁元素除去,结合题意可知将FeCl3杂质还原成Fe除去。
(5)由2(AlCl3·6H2O)转化成Al2(OH)nCl(6-n)可知,
2×(27+35.5×3+6×18)×40%=27×2+17n+35.5×(6-n),求得n=4
(6)先写Al-3e- →AlCl4-,根椐原子守恒和电荷守恒补齐就行。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目

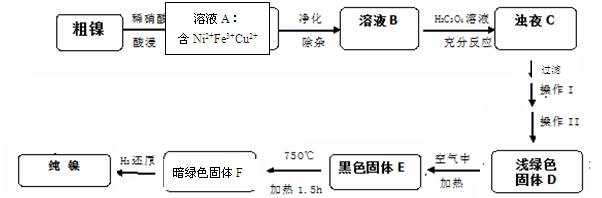
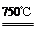 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑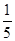 ,则样品中铁、铝的物质的量之比为( )。
,则样品中铁、铝的物质的量之比为( )。