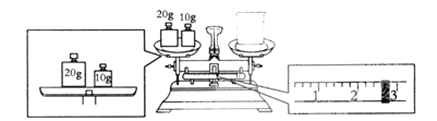
题目内容
【题目】工业上用固体硫酸亚铁制取颜料铁红(Fe2O3)反应原理是:2FeSO4![]() Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有A、B、C三个装置。
Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有A、B、C三个装置。

(1)B中盛放的溶液可以是_________________。
(2)A中放冰的作用是_______________________。
(3)设计一个简单的实验方案探究A中得到的沉淀的成分。___________________________________。
【答案】 品红(或酸性高锰酸钾等) 防止气体溢出,使气体与BaCl2充分反应 A中所得沉淀可能是BaSO4或BaSO3或两者都有。取少量沉淀,加入足量稀HCl,若产生气体则有BaSO3,沉淀未完全溶解则还有BaSO4
【解析】(1)B装置的作用是检验二氧化硫,可以用品红溶液或者酸性高锰酸钾,所以答案为:品红(或酸性高锰酸钾等)。
(2)A装置的作用是收集SO3并使SO3与氯化钡溶液反应,用冰块可以防止气体溢出,使气体与BaCl2充分反应。
(3)A中所得沉淀可能是BaSO4或BaSO3或两者都有。取少量沉淀,加入足量稀HCl,若产生气体则有BaSO3,沉淀未完全溶解则还有BaSO4。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡