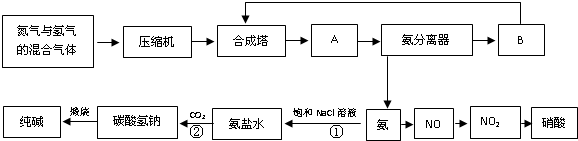
题目内容
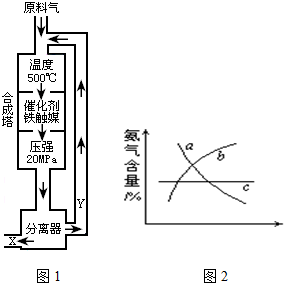
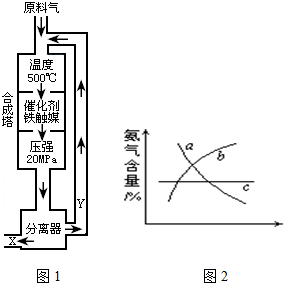
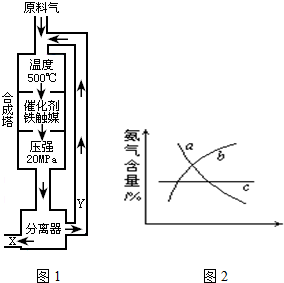
合成氨工业的反应为:N2(g)+3H2(g)?2NH3(g);△H<0工业合成氨生产示意图如图1所示.
(1)写出该反应的化学平衡常数表达式:K=
.随着温度升高,K值
(2)Y的主要成分为
(3)化工生产条件选定的主要原因是(选填字母序号)
A.温度、压强对化学平衡的影响;
B.铁触媒在该温度时活性大;
C.工业生产受动力、材料、设备等条件的限制.
(4)改变反应条件,会使平衡发生移动.如图2象表示随条件改变,氨气的百分含量的变化趋势.
当横坐标为压强时,变化趋势正确的是(选填字母序号)
当横坐标为温度时,变化趋势正确的是(选填字母序号)
(5)合成氨工厂常通过测定反应前后的混合气体密度来确定氮的转化率.某工厂测得合成塔中N2、H2的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体密度为0.693g/L.则该合成氨厂N2的转化率为多少?.

(1)写出该反应的化学平衡常数表达式:K=
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
减小
减小
(填增大、减小、不变)(2)Y的主要成分为
N2、H2
N2、H2
;(3)化工生产条件选定的主要原因是(选填字母序号)
BC
BC
;A.温度、压强对化学平衡的影响;
B.铁触媒在该温度时活性大;
C.工业生产受动力、材料、设备等条件的限制.
(4)改变反应条件,会使平衡发生移动.如图2象表示随条件改变,氨气的百分含量的变化趋势.
当横坐标为压强时,变化趋势正确的是(选填字母序号)
b
b
,当横坐标为温度时,变化趋势正确的是(选填字母序号)
a
a
.(5)合成氨工厂常通过测定反应前后的混合气体密度来确定氮的转化率.某工厂测得合成塔中N2、H2的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体密度为0.693g/L.则该合成氨厂N2的转化率为多少?.
分析:(1)平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值;根据温度升高,平衡逆向移动来判断;
(2)根据该反应为可逆反应以及Y可循环使用;
(3)根据外界条件对化学反应速率及平衡的影响,同时还要考虑实际情况;
(4)根据增大压强,平衡正向移动,NH3含量增大;根据升高温度,平衡逆向移动,NH3含量降低;
(5)先根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算反应前混合气体中N2和H2的体积比,然后根据M=ρVm=
求出转化率;
(2)根据该反应为可逆反应以及Y可循环使用;
(3)根据外界条件对化学反应速率及平衡的影响,同时还要考虑实际情况;
(4)根据增大压强,平衡正向移动,NH3含量增大;根据升高温度,平衡逆向移动,NH3含量降低;
(5)先根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算反应前混合气体中N2和H2的体积比,然后根据M=ρVm=
| m |
| n |
解答:解:(1)根据平衡常数的书写要求,该反应的化学平衡常数表达式K=
,温度升高,平衡逆向移动,c(NH3)减小,c(N2)、c(H2)增大,所以平衡常数减小,故答案为:
,减小;
(2)Y的主要成分为NH3分离后的N2、H2,故答案为:N2、H2;
(3)若要加快化学反应速率及平衡正向移动,应选择高温、高压、催化剂,但催化剂铁触媒在500℃时活性最大,加压有利于平衡正向移动,但对动力、材料、设备等条件要求高,所以压强不能太大,故答案为:BC;
(4)当横坐标为压强时,因为增大压强,平衡正向移动,NH3含量增大,变化趋势正确的是b,当横坐标为温度时,因为反应正向放热,升温,平衡逆向移动,NH3含量降低,变化趋势正确的是a,故答案为:b,a
(5)设反应前混合气体中氮气的物质的量分数为x,氢气物质的量分数为(1-x),依题意得:
28x+2(1-x)=0.5536×22.4 解得x=0.4
所以N2、H2的物质的量之比为2:3
设起始N2的物质的量为2mol,H2为3 mol,N2的转化量为y
N2 +3H2 ?2NH3
2 3 0
y 3y 2y
2-y 3-3y 2y
总物质的量=2-y+3-3y+2y=(5-2y)mol
=0.693×22.4(左右都是反应后气体的摩尔质量)
y=0.5 mol
所以N2的转化率为
×100%=25%,故答案为:25%.
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
(2)Y的主要成分为NH3分离后的N2、H2,故答案为:N2、H2;
(3)若要加快化学反应速率及平衡正向移动,应选择高温、高压、催化剂,但催化剂铁触媒在500℃时活性最大,加压有利于平衡正向移动,但对动力、材料、设备等条件要求高,所以压强不能太大,故答案为:BC;
(4)当横坐标为压强时,因为增大压强,平衡正向移动,NH3含量增大,变化趋势正确的是b,当横坐标为温度时,因为反应正向放热,升温,平衡逆向移动,NH3含量降低,变化趋势正确的是a,故答案为:b,a
(5)设反应前混合气体中氮气的物质的量分数为x,氢气物质的量分数为(1-x),依题意得:
28x+2(1-x)=0.5536×22.4 解得x=0.4
所以N2、H2的物质的量之比为2:3
设起始N2的物质的量为2mol,H2为3 mol,N2的转化量为y
N2 +3H2 ?2NH3
2 3 0
y 3y 2y
2-y 3-3y 2y
总物质的量=2-y+3-3y+2y=(5-2y)mol
| (28×2+2×3) |
| (5-2y) |
y=0.5 mol
所以N2的转化率为
| 0.5 |
| 2 |
点评:本题主要考查平衡常数的概念、平衡移动的判断与计算,难度不大,注意三段式解题法的利用.

练习册系列答案
相关题目