题目内容
Na2CO3是很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:
将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(Ⅰ)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(Ⅱ)小心煮沸溶液1~2分钟;(Ⅲ)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
请回答下列问题:
(1).在(Ⅰ)中,刚通入CO2时发生的反应是 ;而后又发生反应 。(请写出化学方程式)
(Ⅱ)中煮沸溶液的目的是 。
(Ⅲ)中混合另一半NaOH溶液后发生的反应是 (请写出离子方程式)
评价该同学能否制得较纯净的Na2CO3? 。(填“能”或“不能”)
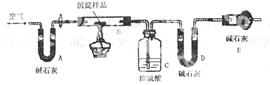
(2).按该同学的设计,第(Ⅰ)步实验装置如下:

①装置A使用的试剂是 (固体)和 溶液;
②装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ;如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。
将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(Ⅰ)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(Ⅱ)小心煮沸溶液1~2分钟;(Ⅲ)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
请回答下列问题:
(1).在(Ⅰ)中,刚通入CO2时发生的反应是 ;而后又发生反应 。(请写出化学方程式)
(Ⅱ)中煮沸溶液的目的是 。
(Ⅲ)中混合另一半NaOH溶液后发生的反应是 (请写出离子方程式)
评价该同学能否制得较纯净的Na2CO3? 。(填“能”或“不能”)
(2).按该同学的设计,第(Ⅰ)步实验装置如下:

①装置A使用的试剂是 (固体)和 溶液;
②装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ;如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。

略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



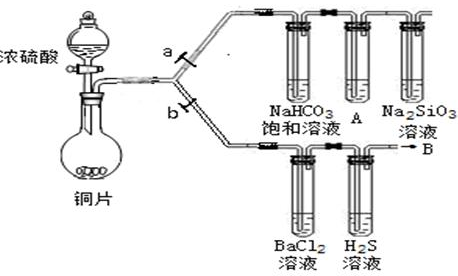
 Y中SO2的含量,设计如下三种方案:
Y中SO2的含量,设计如下三种方案: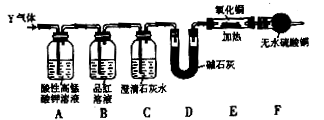
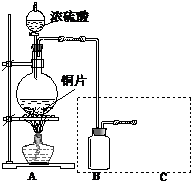
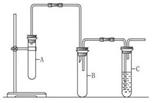
 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验: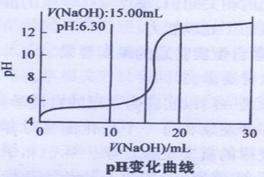
 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。 Cu(OH)2均不带结晶水;
Cu(OH)2均不带结晶水;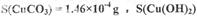
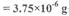 ;若由此数据判断,假设_______是不正确的。
;若由此数据判断,假设_______是不正确的。