题目内容
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
【答案】(1) 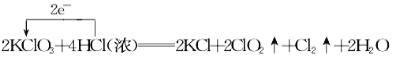 ;
;
(2)1:1;(3)2;(4)11.9;(5)2ClO2 + 2CN- = N2 + 2CO2 + 2Cl- ,50a/13 (或3.85a)。
【解析】
试题分析:(1)根据氧化还原反应的规律,KClO3中+5价Cl得电子转化成ClO2中+4价Cl,HCl中部分-1价Cl失电子转化成Cl2,2molKClO3参加反应共转移2×1mole-=2mol,因此单线桥表示电子转移的情况是: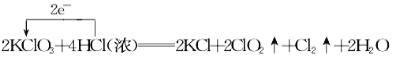 ;
;
(2)KClO3中Cl化合价降低,是养护剂,HCl一部分做还原剂,一部分显酸性,因此两者物质的量为1:1;
(3)根据(1)产生22.4LCl2转移2mole-;
(4)根据c=1000ρw/M,c(HCl)=1000×1.19×36.5%/36.5mol·L-1=11.9mol·L-1;(5)两种气体是N2和CO2,根据化合价的升降法进行配平,2ClO2+2CN-=N2+2CO2+2Cl-,根据离子反应反应方程式,n(ClO2)=n(CN-)=100×103×a×10-3/26mol=50a/13mol。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理