题目内容
下列有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 将某未知溶液中加入2mL2%的CuSO4溶液和数滴NaOH 2%的溶液并加热未见砖红色沉淀产生 | 该溶液中一定不含有醛基 |
| C | 将某气体通入溴水中,溴水褪色 | 该气体一定为不饱和烃 |
| D | 向某溶液中加入NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
D
解析试题分析:A、向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀,该白色沉淀可能是硫酸钡或氯化银,因此该溶液中不一定含有SO42-,A不正确;B、配制氢氧化铜悬浊液时氢氧化钠应该是过量的,否则与醛基不能发生氧化还原反应,B不正确;C、能使溴水褪色的物质可以是二氧化硫、不饱和烃等,因此C不正确;D、气体能使湿润的红色石蕊试纸变蓝,该气体一定是氨气,因此该溶液中一定含有NH4+,D正确,答案选D。
考点:考查物质检验的有关判断

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下: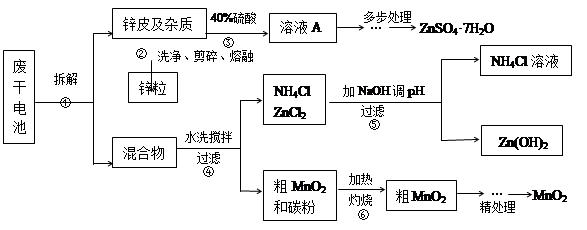
(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb | Zn2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在 ℃左右;
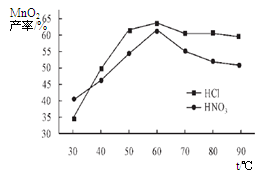
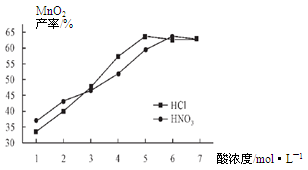
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择 mol/L左右。
用分液漏斗可以分离的一组混合物是 ( )
| A.溴苯和水 | B.乙酸乙酯和乙酸 | C.溴乙烷和乙醇 | D.乙醇和水 |
下列与试验操作相关的描述中,正确的是
| A.制乙酸乙酯时,迅速将乙醇注入浓硫酸中 |
| B.在石油蒸馏装置中,将温度计水银球插入液面以下 |
| C.用铂丝蘸取少量KCl溶液置于火焰上灼烧,直接观察火焰颜色,检验K+的存在 |
| D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
下列有关除杂质(括号中为杂质)的操作中,错误的是
| A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 |
| B.乙醇(水):加入足量生石灰,蒸馏,收集馏出物 |
| C.苯(苯酚):加溴水,振荡,过滤除去沉淀 |
| D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
下列各组物质中只用水就能鉴别的是( )
| A.苯、乙酸、四氯化碳 | B.乙醇、乙醛、乙酸 |
| C.乙醛、乙二醇、硝基苯 | D.苯酚、乙醇、甘油 |
下列实验可实现鉴别目的的是
| A.用KOH溶液鉴别SO3(g)和SO2 |
| B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| C.用CO2鉴别NaAlO2溶液和CH3COONa溶液 |
| D.用BCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
| A.一定有Cl- | B.一定有SO42- | C.一定没有Al3+ | D.一定没有CO32- |
下图所示的实验装置中,不能达到实验目的的是( )
| A.装置①可制取少量蒸馏水 |
| B.装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C.装置③可用于排空气法收集H2、CO2、Cl2、HCl、NO等气体 |
| D.装置④中X物质若为四氯化碳,则可用于吸收氨气或氯化氢 |