题目内容
某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
| A.一定有Cl- | B.一定有SO42- | C.一定没有Al3+ | D.一定没有CO32- |
BD
解析试题分析:将溶液滴在蓝色石蕊试纸上,试纸变红,说明溶液显酸性,因此一定没有CO32-。滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,白色沉淀是硫酸钡,一定有SO42-;在上层清液中滴加硝酸银溶液,产生白色沉淀,白色沉淀是氯化银,但由于前面加入了氯化钡溶液,引入了氯离子,因此不能确定原溶液中是否含有 氯离子。根据溶液的电中性可知Na+、Al3+至少有一种,所以正确的答案选BD。
考点:考查离子共存、离子检验的判断

练习册系列答案
相关题目
下列实验操作中错误的是
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗下层液体应从下口放出,上层液体应从上口倒出 |
| D.萃取操作时,所选萃取剂溶解溶质能力应大于原溶剂且与原溶剂互不相溶 |
下列有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 将某未知溶液中加入2mL2%的CuSO4溶液和数滴NaOH 2%的溶液并加热未见砖红色沉淀产生 | 该溶液中一定不含有醛基 |
| C | 将某气体通入溴水中,溴水褪色 | 该气体一定为不饱和烃 |
| D | 向某溶液中加入NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
下列属于分离、提纯固态有机物的操作的是
| A.蒸馏 | B.萃取 | C.重结晶 | D.分液 |
下列实验能达到目的的是



| A.除去乙烷中混有的乙烯 | B.石油蒸馏 | C.乙醇催化氧化 | D.CO2喷泉实验 |
“酸化”是实验中经常采用的方法,下列说法正确的是
| A.提高高锰酸钾的氧化能力,用浓盐酸酸化 |
| B.抑制Fe2+的水解,用稀硝酸酸化 |
| C.检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验 |
| D.确认溶液中含有SO42-时,先用盐酸酸化,再加BaCl2溶液检验 |
北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)。为了验证他们的猜想,请你选择一种试剂证明甲、乙、丙猜想的正误
| A.硫酸铜溶液 | B.盐酸 | C.稀硝酸 | D.硝酸银溶液 |
下表为各物质中所含少量杂质以及除去这些杂质所选用的试剂或操作方法,正确的是
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| ② | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| ③ | CH4 | C2H4 | 通过盛有酸性高锰酸钾溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发结晶 |
A.④ B.③④ C.①④ D.②③
水溶液X中只可能溶有K+、Mg2+、Al3+、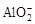 、
、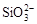 、
、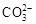 、
、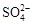 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验: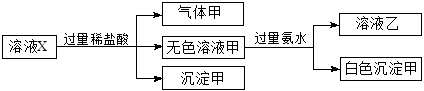
下列判断正确的是
| A.气体甲一定是纯净物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
C.K+、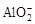 和 和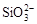 一定存在于溶液X中 一定存在于溶液X中 |
D.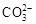 和 和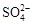 一定不存在于溶液X中 一定不存在于溶液X中 |