题目内容
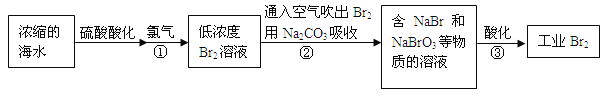
【题目】空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBrb.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
【答案】
(1)![]()
(2)Cl2+2Br—=Br2+2Cl—
(3)富集溴
(4)3Br2+3Na2CO3=5NaBr+3CO2+NaBrO3
(5)5(6)b
【解析】
试题分析:由流程可知,浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气将溴吹出,用纯碱溶液吸收,从而达到富集溴,②中发生3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,③中发生5Br-+6H++BrO3-═3Br2+3H2O。
(1)NaBr为离子化合物,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)反应①是氯气将Br-转化为Br2,反应①的离子方程式是Cl2+2Br-Br2+2Cl-,故答案为:Cl2+2Br-Br2+2Cl-;
(3)由上述分析可知,用Na2CO3吸收的目的是富集溴,故答案为:富集溴;
(4)由上述分析可知,反应②的化学方程式为3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,故答案为:3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3;
(5)③中发生5Br-+6H++BrO3-═3Br2+3H2O,由NaBrO3中溴元素的化合价降低为5-0=5可知,每生成3mol Br2,转移电子的物质的量是5mol,故答案为:5;
(6)除去工业Br2中微量的Cl2,不能选碳酸钠、亚硫酸钠,均与溴、氯气反应,a会引入杂质,只有b中NaBr溶液与Cl2反应,然后分液可除去Cl2,故答案为:b。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案