��Ŀ����
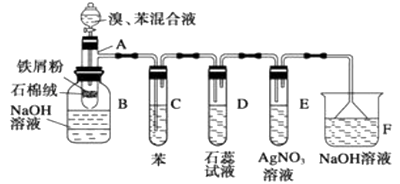
����Ŀ��ijͬѧ������ͼ��ʾ��ʵ��װ�ý�������ˮ������Ӧ��ʵ�飬�������о������仯����IJ������ʡ�
��ش��������⣺
��1��Ӳ���Թ��з�����Ӧ�Ļ�ѧ����ʽΪ____________________________ ��
��2����ͬѧ��ȷ����Ӧ��Ӳ���Թ��й������ʵijɷ֣����������ʵ�鷽����
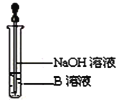
�ٴ�Ӳ���Թ���ȴ��ȡ�������еĹ�����������ϡ�������ҺB��
��ȡ������ҺB�μ�KSCN��Һ������Һ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���______������Һδ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���___________________________��
��3����ͬѧ������ʵ�鷽��������ʵ�飬�����Һδ���ɫ��ԭ���ǣ�__________�������ӷ���ʽ��ʾ����
��4����ͬѧ������ȡ������ҺB��ʹ���NaOH��Һ��Ӧ��������ͼ��ʾ�IJ������ɹ۲쵽���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��������д��������������صķ�Ӧ�Ļ�ѧ����ʽ��_____________________ , _______________________��
��5��һ��ʱ���ͬѧ���֣�3����δ������Һ��ɺ�ɫ��˵��Fe2+ ����_______�ԣ��ɴ˿�֪��ʵ������FeSO4��ҺҪ��ʱ���Ʋ����������۵�ԭ����___________________��
���𰸡� 3Fe + 4H2O(g) ![]() Fe3O4 + 4H2 һ����Fe3O4��������Fe Fe3O4��Fe Fe + 2Fe3+��3Fe2+ FeSO4 + 2NaOH �� Fe(OH)2��+ Na2SO4 4Fe(OH)2 + O2 + 2H2O �� 4Fe(OH)3 ��ԭ Fe2+ �ױ������е���������������
Fe3O4 + 4H2 һ����Fe3O4��������Fe Fe3O4��Fe Fe + 2Fe3+��3Fe2+ FeSO4 + 2NaOH �� Fe(OH)2��+ Na2SO4 4Fe(OH)2 + O2 + 2H2O �� 4Fe(OH)3 ��ԭ Fe2+ �ױ������е���������������
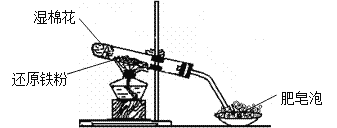
����������1��Ӳ���Թ��з����ķ�Ӧ�ǻ�ԭ������ˮ�����ڸ����µķ�Ӧ����Ӧ������Fe3O4��H2����ѧ����ʽΪ��3Fe + 4H2O(g) ![]() Fe3O4 + 4H2��
Fe3O4 + 4H2��
��2����Ӧ��Ӳ���Թ��еĹ���������һ������Fe3O4�����ܺ���δ��ȫ��Ӧ��Fe��������м���ϡ���ᣬһ�������ķ�Ӧ�У�Fe3O4+8H+=Fe2++2Fe3++4H2O�����ܷ����ķ�Ӧ�У�Fe+2H+=Fe2++H2����Fe+2Fe3+=3Fe2+������������ҺB�еμ�KSCN��Һ������Һ���ɫ����˵����Һ�к���Fe3+����ԭ���������п��ܲ���Fe��Ҳ���ܺ���������Fe������Һδ���ɫ��˵����Һ�в�����Fe3+�������ϡ�������Һ��һ�������ˡ�Fe+2Fe3+=3Fe2+����ԭ��Ϲ�����һ������Fe���ʴ�Ϊ��һ����Fe3O4��������Fe��Fe3O4��Fe��
��3����Һδ���ɫ����Ϊԭ��Ϲ����к���Fe���ʣ�Fe��Fe3+��ԭΪFe2+���Ӷ���Һ�в�����Fe3+����Ӧ�����ӷ���ʽΪFe + 2Fe3+��3Fe2+��
��4����ҺB��NaOH��Һ��Ӧ���۲쵽���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ����֪��ʼ����Fe(OH)2��Ȼ������ΪFe(OH)3����Ӧ�Ļ�ѧ����ʽΪ��FeSO4 + 2NaOH �� Fe(OH)2��+ Na2SO4��4Fe(OH)2 + O2 + 2H2O �� 4Fe(OH)3��
��5����3����δ������Һ��ɺ�ɫ��˵����Һ�е�Fe2+������ΪFe3+����Fe2+���л�ԭ�ԣ��ױ������е��������������ʣ����ʵ������FeSO4��ҺҪ��ʱ���Ʋ����������ۣ���Fe��Ŀ�ľ��ǽ��������ɵ�Fe3+��ԭΪFe2+�������ķ�ӦΪFe + 2Fe3+��3Fe2+���ʴ�Ϊ����ԭ��Fe2+ �ױ������е����������ʡ�

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�