ЬтФПФкШн
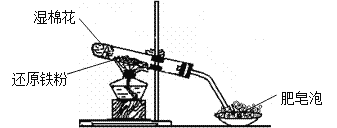
ЁОЬтФПЁП2005ФъХЕБДЖћЛЏбЇНБЛёЕУепЪЉТоПЫЕШШЫЗЂЯжЃЌН№ЪєютЕФПЈБіЛЏКЯЮяПЩвдзїЮЊЗЧГЃгааЇЕФЯЉЬўИДЗжНтДпЛЏМСЁЃЙЄвЕЩЯвБСЖютЕФЛЏбЇдРэЮЊЃЈ ЃЉ
Ђй2MoS2+7O2![]() 2MoO3+4SO2 ЂкMoO3+2NH3ЁЄH2O=ЃЈNH4ЃЉ2MoO4+H2O
2MoO3+4SO2 ЂкMoO3+2NH3ЁЄH2O=ЃЈNH4ЃЉ2MoO4+H2O
ЂлЃЈNH4ЃЉ2MoO4+2HCl=H2MoO4Ё§+2NH4C1 ЂмH2MoO4 MoO3+H2O
ЂнгУЛЙдМСНЋMoO3ЛЙдГЩН№ЪєютЁЃдђЯТСаЫЕЗЈе§ШЗЕФЪЧ
AЃЎЗДгІЂйКЭЂнЖМЪєгкжУЛЛЗДгІ
BЃЎMoO3ЪєгкМюадбѕЛЏЮя
CЃЎдкЗДгІЂйжаMoКЭSОљБЛбѕЛЏ
DЃЎРћгУH2ЁЂCOКЭТСЗжБ№ЛЙдЕШСПЕФMoO3ЃЌЫљЯћКФЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ2:2:3
ЁОД№АИЁПC
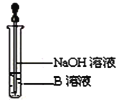
ЁОНтЮіЁПвЛжжЕЅжЪгывЛжжЛЏКЯЮяЗДгІЃЌЩњГЩСэЭтвЛжжЕЅжЪКЭСэЭтвЛжжЛЏКЯЮяЕФЗДгІЪЧжУЛЛЗДгІЃЌЫљвдбЁЯюAВЛе§ШЗЃЛИљОнЗДгІЂкПЩжЊЃЌMoO3ЪєгкЫсадбѕЛЏЮяЃЌбЁЯюBВЛе§ШЗЃЛдкЗДгІЂйжаMoКЭSдЊЫиЕФЛЏКЯМлЖМЪЧЩ§ИпЕФЃЌОљБЛбѕЛЏЃЌе§ШЗЃЛЛЙдЕШСПЕФMoO3ЃЌдђзЊвЦЕФЕчзгЪ§ЪЧЯрЕШЕФЃЌбЁЯюDВЛе§ШЗЃЌД№АИбЁCЁЃ

 гфПьЕФКЎМйФЯОЉГіАцЩчЯЕСаД№АИ
гфПьЕФКЎМйФЯОЉГіАцЩчЯЕСаД№АИЁОЬтФПЁПжЛИјГіЯТСаМзКЭввжаЖдгІЕФСПЃЌВЛФмзщГЩвЛИіЧѓЮяжЪЕФСПЕФЙЋЪНЕФЪЧ(ЁЁЁЁ)
Ђй | Ђк | Ђл | Ђм | Ђн | |
Мз | ЮяжЪСЃзгЪ§ | БъзМзДПіЯТЦјЬхФІЖћЬхЛ§ | ЙЬЬхЬхЛ§ | ЮяжЪЕФжЪСПЗжЪ§ | ЗЧБъзМзДПіЯТ ЮяжЪЕФжЪСП |
вв | АЂЗќМгЕТТоГЃЪ§ | БъзМзДПіЯТЦјЬхЬхЛ§ | ЙЬЬхУмЖШ | ШмвКЕФЬхЛ§ | ЮяжЪЕФФІЖћжЪСП |
A. ЂкЂн B. ЂйЂк
C. ЂлЂм D. ЂйЂн