题目内容
(2011?重庆)下列叙述正确的是( )
分析:A.氯气具有强氧化性,HCl为弱氧化性酸;
B.硫酸钾为强酸强碱盐,硫酸锌为强酸弱碱盐;
C.电子层越多,半径越大,碱金属的密度Li的大于Na的;
D.非金属性越强,最高价氧化物对应水化物的酸性越强.
B.硫酸钾为强酸强碱盐,硫酸锌为强酸弱碱盐;
C.电子层越多,半径越大,碱金属的密度Li的大于Na的;
D.非金属性越强,最高价氧化物对应水化物的酸性越强.
解答:解:A.Fe分别与氯气和稀盐酸反应所得氯化物为氯化铁、氯化亚铁,故A错误;
B.K、Zn分别与不足量的稀硫酸反应所得溶液分别显中性、酸性,故B错误;
C.Li、Na、K的原子半径随原子序数的增加而增大,Li、Na、K的密度随原子序数的增加先减小后增大,故C错误;
D.C、P、S、Cl的非金属性增强,则最高价氧化物对应水化物的酸性逐渐增强,故D正确;
故选D.
B.K、Zn分别与不足量的稀硫酸反应所得溶液分别显中性、酸性,故B错误;
C.Li、Na、K的原子半径随原子序数的增加而增大,Li、Na、K的密度随原子序数的增加先减小后增大,故C错误;
D.C、P、S、Cl的非金属性增强,则最高价氧化物对应水化物的酸性逐渐增强,故D正确;
故选D.
点评:本题考查元素周期律,明确同周知、同主族元素的性质变化规律即可解答,题目难度不大,注意氯气具有强氧化性来解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


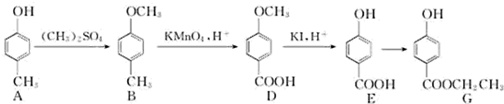
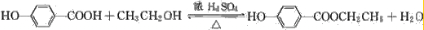
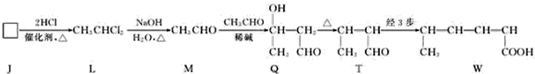
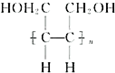 ,为避免R-OH+HO-R
,为避免R-OH+HO-R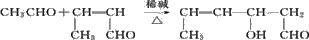
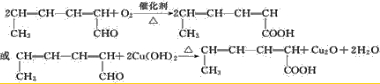
 (2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2011?重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.