题目内容
(2011?重庆)用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
(1)Al的原子结构示意图为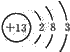
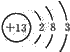 ;Al与NaOH溶液反应的离子方程式为
;Al与NaOH溶液反应的离子方程式为
(2)30Si原子的中子数为
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体.则此熔渣中Al2O3的质量分数为
(1)Al的原子结构示意图为
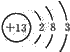
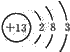
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(2)30Si原子的中子数为
16
16
,SiO2的晶体类型为原子晶体
原子晶体
.(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
HCl
HCl
.(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
CO2
CO2
.(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体.则此熔渣中Al2O3的质量分数为
25%
25%
.分析:(1)铝是13号元素,原子核外有13个电子,根据电子排布规律写出原子结构示意图,铝和氢氧化钠反应生成偏铝酸钠和氢气,注意该反应中水是反应物;
(2)中子数=质量数-质子数,根据晶体中存在的微粒判断晶体类型;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物沸点反常;
(4)高温下,大理石分解生成气体CO2;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅,滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据铁原子守恒计算氧化铁的质量,剩余的质量就是氧化铝,再根据质量分数公式进行计算.
(2)中子数=质量数-质子数,根据晶体中存在的微粒判断晶体类型;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物沸点反常;
(4)高温下,大理石分解生成气体CO2;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅,滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据铁原子守恒计算氧化铁的质量,剩余的质量就是氧化铝,再根据质量分数公式进行计算.
解答:解:(1)铝原子的原子结构示意图为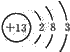 ,铝和氢氧化钠、水反应生成偏铝酸钠和氢气,发生的离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:
,铝和氢氧化钠、水反应生成偏铝酸钠和氢气,发生的离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为: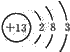 ;2Al+2OH-+2H2O═2AlO2-+3H2↑;
;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)中子数=质量数-质子数=30-14=16,二氧化硅晶体中含有硅原子和氧原子,原子间以共价键形成空间网状结构,属于原子晶体,故答案为:16;原子晶体;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但HF中含有氢键导致HF的沸点大于HCl,所以该族氢化物中沸点最低的是HCl,
故答案为:HCl;
(4)高温下,大理石分解生成气体CO2,所以该气体是二氧化碳,故答案为:CO2;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅;
滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据2
Fe(OH)3→Fe2O3,氧化铁的质量=
g=16g,氧化铝的质量=(36.0-11.0-16)g=9g,氧化铝的质量分数=
×100%=25%,
故答案为:25%.
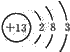 ,铝和氢氧化钠、水反应生成偏铝酸钠和氢气,发生的离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:
,铝和氢氧化钠、水反应生成偏铝酸钠和氢气,发生的离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为: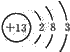 ;2Al+2OH-+2H2O═2AlO2-+3H2↑;
;2Al+2OH-+2H2O═2AlO2-+3H2↑; (2)中子数=质量数-质子数=30-14=16,二氧化硅晶体中含有硅原子和氧原子,原子间以共价键形成空间网状结构,属于原子晶体,故答案为:16;原子晶体;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但HF中含有氢键导致HF的沸点大于HCl,所以该族氢化物中沸点最低的是HCl,
故答案为:HCl;
(4)高温下,大理石分解生成气体CO2,所以该气体是二氧化碳,故答案为:CO2;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅;
滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据2
| 160×21.4 |
| 214 |
| 160×21.4 |
| 214 |
| 9g |
| 36g |
故答案为:25%.
点评:本题考查铝的有关知识,注意铝和氢氧化钠的反应中,水是反应物,很多学生书写离子方程式时易漏写水而导致错误,为易错点.

练习册系列答案
相关题目

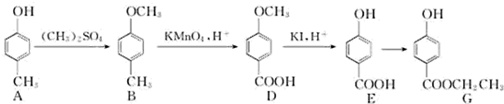
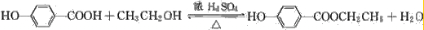
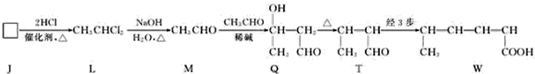
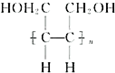 ,为避免R-OH+HO-R
,为避免R-OH+HO-R