题目内容
【题目】(1)书写浓硫酸与木炭在加热条件下的化学方程式为__________。
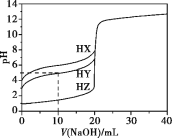
(2)试用下列各装置设计一个实验,验证上述反应所产生的各种产物。 这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):__________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,证明___________,B瓶溶液的作用____________,C瓶的溶液有___________现象,证明____________。
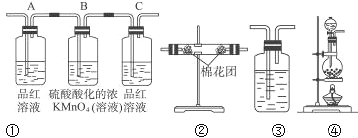
(4)书写B中的离子方程式____________。B中放置溴水不如高锰酸钾的原因____________________________。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
【答案】C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O ④ ② ① ③ 产物中存在二氧化硫 将产物中的二氧化硫氧化除尽 溶液不褪色 二氧化硫已被除尽 5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42- 溴单质在水溶液中的溶解度较小,可能无法完全氧化二氧化硫 澄清石灰水 CO2
2SO2↑+CO2↑+2H2O ④ ② ① ③ 产物中存在二氧化硫 将产物中的二氧化硫氧化除尽 溶液不褪色 二氧化硫已被除尽 5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42- 溴单质在水溶液中的溶解度较小,可能无法完全氧化二氧化硫 澄清石灰水 CO2
【解析】
碳和浓硫酸在加热条件下反应生成SO2、CO2和水,检验二氧化碳和二氧化硫时用到的溶液中均含有水,首先用无水硫酸铜检验产物水, SO2和CO2均能使澄清石灰水变浑浊,故应先用B中品红溶液检验二氧化硫,后用澄清石灰水检验二氧化碳,在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,C中品红溶液用于检验SO2是否除干净.
(1)浓硫酸与木炭在加热条件下的化学方程式为C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)由上述分析可以知道,装置的连接顺序(按产物气流从左到右的方向)是:④→②→①→③;
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是:检验产物中的SO2,B瓶溶液的作用是:将SO2全部氧化吸收,C瓶溶液的作用是:确定产物中SO2已被B瓶溶液全部氧化;
(4)B中酸性高锰酸钾将二氧化硫氧化,方程式为5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,B中放置溴水不如高锰酸钾的原因是溴单质在水溶液中的溶解度较小,可能无法完全氧化二氧化硫;
(5)装置③可用来验证产物二氧化碳,可盛装的药品为澄清石灰水。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】对于如下反应,其反应过程的能量变化示意图如图:

编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g)=B(g)+C(g) | K1 | △H1 |
反应② | B(g)+C(g)=D(g) | K2 | △H2 |
反应③ | A(g)= D(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快D.则增大压强,K1减小,K2增大,K3不变