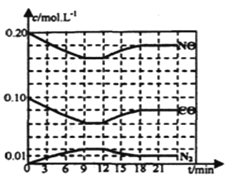
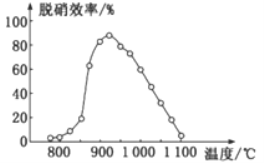
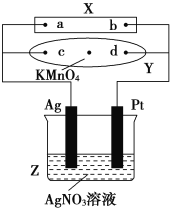
题目内容
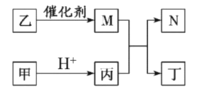
【题目】X、Y、Z、W 是原子序数依次增大的短周期主族元素, 且 X、Z 原子序数之和是 Y、W 原子序数之和的![]() 。甲、乙 、丙、丁是由这些元素组成的二元化合物, M 是某种元素对应的单质, 乙和丁的组成元素相同, 且乙是一种“绿色氧化剂”, 化合物 N 是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是:
。甲、乙 、丙、丁是由这些元素组成的二元化合物, M 是某种元素对应的单质, 乙和丁的组成元素相同, 且乙是一种“绿色氧化剂”, 化合物 N 是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是:
A.沸点:丁>丙,热稳定性:丁>丙
B.原子半径: r(Y) > r(Z) > r(W)
C.Z 与 X、Y、W 形成的化合物中,各元素均满足 8 电子结构
D.化合物N 与乙烯均能使溴水褪色, 且原理相同
【答案】A
【解析】
乙是一种“绿色氧化剂”,即乙为H2O2,乙和丁组成的元素相同,则丁为H2O,化合物N是具有漂白性的气体(常温下),则N为SO2,根据转化关系,M是单质,H2O2分解成O2和H2O,即M为O2,甲在酸中生成丙,丙为二元化合物,且含有S元素,即丙为H2S,四种元素原子序数依次增大,且都为短周期元素,X为H,Y为O,如果W为S,X、Z原子序数之和是Y、W原子序数之和的1/2,则Z为Na,如果Z为S,则W不符合要求。
A. 丁为H2O,丙为H2S,非金属性:O>S,则热稳定性:H2O>H2S,同时水分子间存在氢键,则沸点:H2O>H2S ,A项正确;
B. 同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径大小顺序是r(Na)>r(s)>r(O),B项错误;
C. 形成化合物分别是NaH、Na2O/Na2O2、Na2S,NaH中H最外层有2个电子,不满足8电子结构,C项错误;
D. SO2能使溴水褪色,发生SO2+Br2+H2O=2HBr+H2SO4,利用SO2的还原性,乙烯和溴水反应,发生的加成反应,原理不同,D项错误;
答案选A。